
题目列表(包括答案和解析)

(17分)某校化学兴趣小组为了探究原电池工作原理,进行如下系列实验:
实验一 实验二
实验三 实验四
结果:
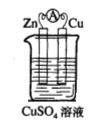
(1)实验一中铜片、锌片表面均有红色物质析出,电流计指针偏转,但较短时间内电流即明显减小。实验结束时测得锌片减少了3.94g,铜片增重了3.84g,则该原电池的工作效率是(指参加原电池反应的锌占反应总量的百分率): 。
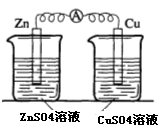
(2)实验二中刚将铜、锌片插入溶液中时电流计指针有偏转,但立即就归零了。为什么锌的电子不能持续通过导线流向铜极给Cu2+? 。
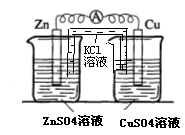
(3)实验三中盐桥中K+流向 溶液(填ZnSO4或CuSO4),如果Zn的消耗速率为1×10-3mol/s,则K+的迁移速率为 mol/s。
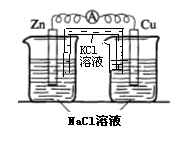
(4)实验四中电流计指针有偏转,写出铜极的电极反应式: ![]()
 某校化学兴趣小组同学,利用下列装置探究pH试纸上的微型电解。
某校化学兴趣小组同学,利用下列装置探究pH试纸上的微型电解。
(1)如图,取一条广泛pH试纸,浸润了饱和Na2SO4溶液后放置于玻璃片上,取两只回形针(铁制)夹住试纸两端,另取导线、鳄鱼夹、6v电池连接好电路。
当两根鳄鱼夹夹住回形针后,试纸上立刻出现以下现象:
|
紫色,对照比色卡发现其pH约为13。
①如图,右端回形针为 极(填“阴”或“阳”);
阴极试纸上出现大片蓝紫色的原因是(用反应式结合文字表示):
。
②推测阳极回形针处出现的红棕色物质可能是 (写化学式),为证明该种物质的存在,请设计一个简单的实验,该实验的操作过程是:
。
(2)小组同学另取两根铅笔芯作为电极,对pH试纸上的Na2SO4溶液电解,可见阳极与试纸接触处呈现 色圆点,而在阴极与试纸接触处呈现 色圆点,说明了电解硫酸钠饱和溶液的实质是: (用方程式表示)。
(3)将pH试纸用饱和NaCl浸润,采用类似(2)操作,如图。接通直流电源一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。
 请分析此极出现该现象的原因:(用必要文字及方程式表述)
请分析此极出现该现象的原因:(用必要文字及方程式表述)
。
某校化学兴趣小组同学,利用下列装置探究pH试纸上的微型电解。
 (1)如图,取一条广泛pH试纸,浸润了饱和Na2SO4溶液后放置于玻璃片上,取两只回形针(铁制)夹住试纸两端,另取导线、鳄鱼夹、6v电池连接好电路。
(1)如图,取一条广泛pH试纸,浸润了饱和Na2SO4溶液后放置于玻璃片上,取两只回形针(铁制)夹住试纸两端,另取导线、鳄鱼夹、6v电池连接好电路。
当两根鳄鱼夹夹住回形针后,试纸上立刻出现以下现象:
|
紫色,对照比色卡发现其pH约为13。
①如图,右端回形针为 极(填“阴”或“阳”);
阴极试纸上出现大片蓝紫色的原因是(用反应式结合文字表示): 。
②推测阳极回形针处出现的红棕色物质可能是 (写化学式),为证明该种物质的存在,请设计一个简单的实验,该实验的操作过程是: 。
 (2)小组同学另取两根铅笔芯作为电极,对pH试纸上的Na2SO4溶液电解,可见阳极与试纸接触处呈现 色圆点,而在阴极与试纸接触处呈现 色圆点,说明了电解硫酸钠饱和溶液的实质是: (用方程式表示)。
(2)小组同学另取两根铅笔芯作为电极,对pH试纸上的Na2SO4溶液电解,可见阳极与试纸接触处呈现 色圆点,而在阴极与试纸接触处呈现 色圆点,说明了电解硫酸钠饱和溶液的实质是: (用方程式表示)。
(3)将pH试纸用饱和NaCl浸润,采用类似(2)操作,如图。接通直流电源一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。
请分析此极出现该现象的原因:(用必要文字及方程式表述)
 (2011?宣城二模)某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
(2011?宣城二模)某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3mL溶液装于试管,向试管中加入几滴KSCN溶液. | 若溶液变红色,则溶液含有Fe3+; 若无现象,则不含Fe3+ 若溶液变红色,则溶液含有Fe3+; 若无现象,则不含Fe3+ |
Fe3++3SCN-=Fe(SCN)3 Fe3++3SCN-=Fe(SCN)3 |
| 第二步 | 另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 |
若溶液紫色褪去,则溶液含有Fe2+; 若无明显变化,则不含Fe3+. |
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com