实验室配制480mL0.1mol/LNa
2CO
3溶液回答下列问题
(1)应用托盘天平称取十水合碳酸钠(Na
2CO
3?10H
2O)晶体
14.3
14.3
g.
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,1g以下用游码,天平平衡时,则实际称量的十水合碳酸钠质量
B
B
(填符号 A、偏高 B、偏低 C、不变)
(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为(同一步骤可用多次) B→A→
D
D
→F→
C
C
→F→E
A、调整零点 B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量 D、称量空的小烧杯
E、将砝码放回砝码盒内 F、记录称量结果
(4)配制Na
2CO
3溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、
500mL容量瓶
500mL容量瓶
、
胶头滴管
胶头滴管
.
(5)若实验遇下列情况,溶液的浓度是 A、偏高 B、偏低 C、不变(用符号回答)
A、加水定容时越过刻度线
B
B
B、忘记将洗涤液转入容量瓶
B
B
C、容量瓶内壁附有水珠而未干燥处理
C
C
D、溶解后没有冷却便进行定容
A
A
E、称量的碳酸钠晶体部分失水
A
A
(6)请你帮助把标签上的内容写一下(如右图).
Na2CO3溶液
Na2CO3溶液
,
0.1
0.1
mol/L.

 实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题
实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题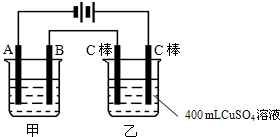 如图为为串联的甲、乙两电解池,试回答:
如图为为串联的甲、乙两电解池,试回答: