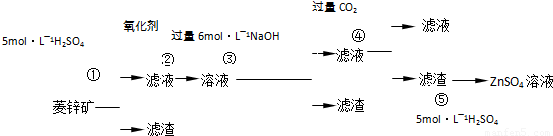
(2010?启东市模拟)锌钡白是一种白色颜料.工业上是由ZnSO
4与BaS溶液混合而成:BaS+ZnSO
4=ZnS↓+BaSO
4↓.以下是工业生产流程.请回答有关问题:
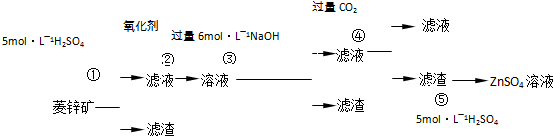
Ⅰ.ZnSO
4溶液的制备与提纯有关资料:已知Zn(OH)
2与Al(OH)
3相似,能溶于过量的NaOH溶液生成Na
2ZnO
2;菱锌矿的主要成分是ZnCO
3,含少量SiO
2、FeCO
3、Cu
2(OH)
2CO
3等.
(1)②中使用的氧化剂最好是下列的
B
B
(填序号),理由是
不会引入杂质
不会引入杂质
.
A.Cl
2 B.H
2O
2 C.KMnO
4 D.浓HNO
3(2)写出反应④的离子方程式:
ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-
ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-
.
(3)为了达到综合利用、节能减排的目的,上述流程中步骤
①
①
产生的
CO2
CO2
可以用于步骤
④
④
(其中步骤选填①、②、③、④、⑤).
Ⅱ.BaS溶液的制备
有关数据:Ba(s)+S(s)+2O
2(g)=BaSO
4(s);△H=-1473.2kJ?mol
-1C(s)+-O
2(g)=CO(g);△H=-110.5kJ?mol
-1Ba(s)+S(s)=BaS(s);△H=-460kJ?mol
-1重晶石(BaSo4)矿粉、煤粉
BaS+CO↑
BaS溶液
(4)煅烧还原的热化学方程式为:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1
BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1
.
(5)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)
S2-+H2O?HS-+OH-
S2-+H2O?HS-+OH-
.
Ⅲ.制取锌钡白
(6)Ⅰ中步骤⑤使用硫酸的量要适当,如果所得溶液的酸性过强,产生的后果是
酸性过强,与BaS溶液混合是可能产生H2S气体污染,锌钡白的产率会降低
酸性过强,与BaS溶液混合是可能产生H2S气体污染,锌钡白的产率会降低
.

 BaS+CO↑
BaS+CO↑ BaS溶液
BaS溶液
 BaS+CO↑
BaS+CO↑ BaS溶液
BaS溶液
 BaS+CO↑
BaS+CO↑ BaS溶液
BaS溶液