【化学--物质结构与性质】
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成对电子;A与B可形成离子化合物B
3A
2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E的原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是
,A、B、C、D的第一电离能由小到大的顺序为
;
(2)B的氧化物的熔点远高于D的氧化物的熔点,理由是
;
(3)A的最高价含氧酸根离子中,其中心原子是
杂化,D的低价氧化物分子的空间构型是
;
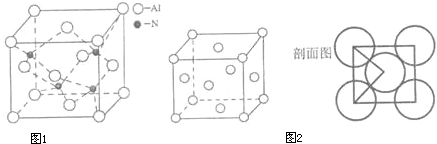
(4)A、C形成某种化合物的晶胞结构如图1所示,则其化学式为
;(每个球均表示1个原子)
(5)铜晶体的晶胞结构如图2,若铜原子的半径是rcm,则铜的密度的计算式是
(用N
A表示阿伏伽德罗常数).

