
题目列表(包括答案和解析)


TiO2在工业生产和日常生活中有重要用途。
(1)工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的主要反应为:2H2SO4+FeTiO3 == TOSO4(硫酸氧钛)+FeSO4+2H2O
净化钛矿石时,需用浓氢氧化钠溶液来处理。写出该过程中发生反应的化学方程式:________________。
步骤③中加热的目的是(请写出必要的化学方程式和文字): 。
(2)用TiO2制备金属钛的一种方法是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2(s)+2Cl2(g) TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
已知:C(s)+O2(g)=CO2(g) △H= 394
kJ/mol。
394
kJ/mol。
则TiO2(s)+C(s)+2Cl2(g)=TiCl4(1)+CO2(g) △H=________
从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因是_______________。
(3)下图是一种染料敏化太阳能电池的示意图。电池的一个由有机光敏染料(S)涂覆TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:

TiO2/S TiO2/S*
(激发态)
TiO2/S*
(激发态)
TiO2/S*  TiO2/S+
+ e-
TiO2/S+
+ e-
I3-+2e- 3I-
3I-
2TiO2/S*+I3-  2TiO2/S + I3-
2TiO2/S + I3-
下列关于该电池叙述正确的是
A.电池工作时,I-离子在镀铂导电玻璃电极上放电
B.电池工作时,是将太阳能转化为电能
C.电池的电解质溶液中I-和I3- 浓度不会减少
D.电池中镀铂导电玻璃为正极
TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答: (填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答: 。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s)+2Cl2 (g)TiCl4(l)+O2(g) ΔH=+151 kJ·mol-1
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s)+O2 (g) =CO2 (g) ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C(s)+2Cl2 (g) = TiCl4 (l)+CO2(g) ΔH= ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答: (填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答: ; 。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti:将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2 (s)+2Cl2 (g) 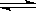 TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(4)已知:C(s)+O2 (g) = CO2 (g) ; ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C (s)+2Cl2 (g) = TiCl4 (l)+CO2 (g); ΔH= ______________
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com