
题目列表(包括答案和解析)
 (1)某化学探究小组对SO2的化学性质进行以下探究并写如下实验报告.请帮助他完成实验报告
(1)某化学探究小组对SO2的化学性质进行以下探究并写如下实验报告.请帮助他完成实验报告| 物质 | 类别 | 化学性 质预测 |
实验验证(仪器:试管、胶头滴管) | ||
| 实验操作 | 现象 | 实质(离子方程式表示) | |||
| SO2 | 酸性氧化物 | 可以和水反应 | 将盛满二氧化硫气体的试管倒立在水中,并测定试管中溶液的pH | SO2+H2O=H2SO3 | |
| 与碱反应 | 出现白色沉淀 | ||||
| 装置 | 药品 | 作用 |
| B | 酸性KMnO4溶液 | 验证SO2的还原性 |
| C | ||
| D |
| ||
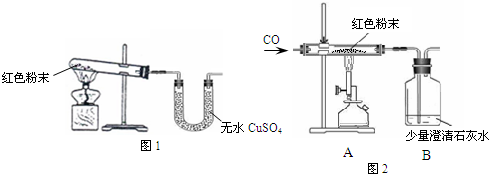
| 反应前 | 反应后 | |
| Ⅰ 组 |
玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ 组 |
洗气瓶和所盛溶液 的总质量为180.0g |
洗气瓶和瓶中物质 的总质量为183.1g |
| 物质 | 类别 | 化学性 质预测 | 实验验证(仪器:试管、胶头滴管) | ||
| 实验操作 | 现象 | 实质(离子方程式表示) | |||
| SO2 | 酸性氧化物 | 可以和水反应 | 将盛满二氧化硫气体的试管倒立在水中,并测定试管中溶液的pH | SO2+H2O=H2SO3 | |
| 与碱反应 | 出现白色沉淀 | ||||
| 装置 | 药品 | 作用 |
| B | 酸性KMnO4溶液 | 验证SO2的还原性 |
| C | ||
| D |

 Fe2O3+3H2O
Fe2O3+3H2O
| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ 组 | 洗气瓶和所盛溶液 的总质量为180.0g | 洗气瓶和瓶中物质 的总质量为183.1g |
| 物质 | 类别 | 化学性 质预测 | 实验验证(仪器:试管、胶头滴管) | ||
| 实验操作 | 现象 | 实质(离子方程式表示) | |||
| SO2 | 酸性氧化物 | 可以和水反应 | 将盛满二氧化硫气体的试管倒立在水中,并测定试管中溶液的pH | SO2+H2O=H2SO3 | |
| 与碱反应 | 出现白色沉淀 | ||||
| 装置 | 药品 | 作用 |
| B | 酸性KMnO4溶液 | 验证SO2的还原性 |
| C | ||
| D |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com