
题目列表(包括答案和解析)
| ||

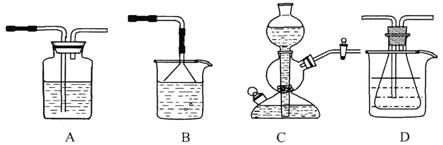
(10分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳酸钙;D:含氨的饱和食盐水、水
四种盐在不同温度下的溶解度(g/100g水)表
|
|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36_3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
—① |
— |
— |
— |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
|
|
NH4Cl |
29.4 |
33.3 |
37.2[来源:Z|xx|k.Com] |
41.4 |
45.8[来源:Z*xx*k.Com] |
50.4 |
55.3 |
77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是 (填字母)。
(2)A装置中盛放的试剂是 ,其作用是 。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是 。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)
(5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业作出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、NH3和CO2为原料制得NaHCO3,进而生产出纯碱。相关的化学反应有:①NH3+CO2+H2O===NH4HCO3;②NH4HCO3+NaCl===NaHCO3↓+NH4Cl;③2NaHCO3 Na2CO3+CO2↑+H2O↑。某研究性学习小组的同学模拟“侯氏制碱法”,提出下列三种制备NaHCO3的实验方案。
Na2CO3+CO2↑+H2O↑。某研究性学习小组的同学模拟“侯氏制碱法”,提出下列三种制备NaHCO3的实验方案。
方案1:分别将CO2和NH3通入到饱和食盐水中;
方案2:将CO2通入到含NH3的饱和食盐水中;
方案3:将NH3通入到含CO2的饱和食盐水中。
(1)经过讨论,大家一致认为方案2较合理,请说明方案3的不足之处
________________________________________________________________________。
(2)根据方案2,某同学设计了如下实验步骤和装置图:
步骤1:配制含氨的饱和食盐水。在100 mL锥形瓶中加入20 mL氨水(体积比1∶1),再加入8 g食盐,塞紧橡皮塞,振荡几分钟,过滤除去不溶物,得到含氨的饱和食盐水。
步骤2:制备NaHCO3。按图组装实验装置,先检查装置的气密性,再向各仪器中加入相应的试剂制备NaHCO3。实验过程中,需要控制温度在30~35 ℃(大于35 ℃时NH4HCO3会分解)和CO2的通入速度(以出现能数得清的连续气泡为宜)。反应结束后,把锥形瓶浸入冷水中,使较多的晶体析出,过滤、洗涤。

请回答下列问题:
①为控制反应温度在30~35 ℃,应采用的操作方法是________________________。
②装置B中的试剂是__________________,它的作用是__________________________。
③检验步骤2中所得晶体是NaHCO3而不是NaCl的实验方法和现象是
________________________________________________________________________
________________________________________________________________________。
④设计一个简单的实验方案证明Na2CO3溶液呈碱性是由CO32-引起的
________________________________________________________________________
________________________________________________________________________。
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2 O
O NH4HCO3; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3
Na2CO3 +CO2↑+H2O
+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号);
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小, 所以在溶液中首先结晶析出
所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制 碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如右图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是
(Ⅰ)乙装置中的试剂是 
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
(IV)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O NH4HCO3; NH4HCO3+NaCl NaHCO3↓+NH4Cl;
2NaHCO3Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号);
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如右图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
|
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
(IV)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com