
题目列表(包括答案和解析)
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol.L-1 | |
| H2O | Fe2- | ||||
| (1) | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| (2) | 探究温度对降解反应速的影响率 | ||||
| (3) | 298 | 10 | 6.0 | 0.30 | |


 Fe(SCN)2+来检验反应是否产生铁离子.已知在一定温度下该反应达到平衡时c(Fe3+)=0.04mol?L-1,c(SCN-)=0.1mol?L-1,c[Fe(SCN)2+]=0.68mol?L-1.则此温度下该反应的平衡常数K=
Fe(SCN)2+来检验反应是否产生铁离子.已知在一定温度下该反应达到平衡时c(Fe3+)=0.04mol?L-1,c(SCN-)=0.1mol?L-1,c[Fe(SCN)2+]=0.68mol?L-1.则此温度下该反应的平衡常数K=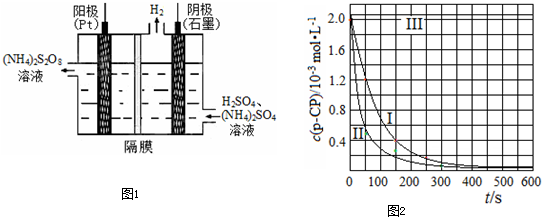
| 实验 编号 |
T/K | pH | c/10-3mol?L-1 | |
| H2O2 | Fe2+ | |||
| Ⅰ | 298 | 3 | 6.0 | 0.30 |
| Ⅱ | 313 | 3 | 6.0 | 0.30 |
| Ⅲ | 298 | 10 | 6.0 | 0.30 |
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
|
实验 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |
【数据处理】实验测得p-CP的浓度随时间变化的关系如下图。

(2)请根据上图实验①曲线,计算降解反应在50~150s内的反应速率:
υ(p-CP)= mol·L-1·s-1
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:
。
(4)实验③得出的结论是:pH等于10时, 。
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法 。
![]() Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和![]() 浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
![]() [实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
![]() (1)请完成以下实验设计表(表中不要留空格)。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验
| 实验目的 | T/K | PH | c/10-3mol·L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ |
| 298 | 10 | 6.0 | 0.30 |
![]() [数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。

![]() (2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
![]()
![]() (p-CP)= mol·L-1·s-1
(p-CP)= mol·L-1·s-1
![]() [解释与结论]
[解释与结论]
![]() (3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
![]() (4)实验③得出的结论是:PH等于10时, 。
(4)实验③得出的结论是:PH等于10时, 。
![]() [思考与交流]
[思考与交流]
![]() (5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法: ![]()
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com