
题目列表(包括答案和解析)
(08长沙雅礼中学二模)由硫酸镁、硫酸铝两种溶液组成的100mL混合溶液中,SO![]() 的物质的量浓度为0.10mol/L,加入0.30mol/LNaOH溶液到生成的白色沉淀恰好不再溶解为止,消耗NaOH的体积为100mL,则在所得的混合液AlO
的物质的量浓度为0.10mol/L,加入0.30mol/LNaOH溶液到生成的白色沉淀恰好不再溶解为止,消耗NaOH的体积为100mL,则在所得的混合液AlO![]() 的物质的量浓度为( )
的物质的量浓度为( )
A.0.025mol/L B.0.05mol/L C.0.10mol/L D.0.25mol/L
| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+●提出假设: (1)假设①:该混合金属粉末中除镁外还含有 Al Al 元素假设②:该混合金属粉末中除镁外还含有 Zn Zn 元素假设③:该混合金属粉末中除镁外还含有铝、锌元素 ●实验探究: 甲同学基于假设③设计实验方案如下:乙同学同样基于假设③设计另一实验方案如下: 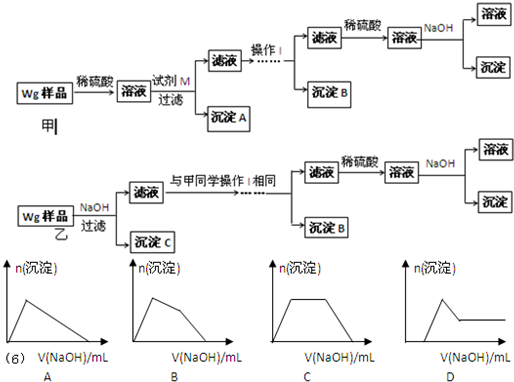 (2)试剂M是 NaOH溶液 NaOH溶液 ;沉淀B是Al(OH)3 Al(OH)3 .(3)丙同学认为乙同学的方案比甲同学的好,理由是 步骤简单,节约试剂 步骤简单,节约试剂 .(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是 将沉淀C洗涤、小心干燥后称量 将沉淀C洗涤、小心干燥后称量 .(5)操作Ⅰ的主要过程是:在滤液中逐滴加入 稀硫酸 稀硫酸 ,直至生成的沉淀刚好溶解,再加入足量的稀氨水 稀氨水 .(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图象正确的是 B B .
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中—题,并在相应的答题区域作答。若两题都做,则按A题评分。 A.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。 (1)请参考下述数据填空和回答问题: 工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因 ;不用电解AlCl3的方法生产铝的原因 。 (2)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。 (3)写出Cu+的核外电子排布式 。 (4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。 (5)某喹喏酮类药物(中心离子是Cu2+)结构如下图,关于该药物的说法正确的是 。 A.中心离子Cu2+的配位数是5 B.N原子均采用sp2杂化 C.存在配位键、极性共价键和非极性共价键 D.熔点很高,硬度很大 B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验: 步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。 步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10% 碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。 步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。 测定过程中发生的相关反应如下: ① ②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62- 请回答下列问题: (1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是 ,碘瓶不干燥会发生反应的化学方程式 。 (2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是 。 (3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。 (4)反应结束后从液体混合物中回收四氯化碳,所需操作有 。
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中—题,并在相应的答题区域作答。若两题都做,则按A题评分。 (12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中—题,并在相应的答题区域作答。若两题都做,则按A题评分。 A.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。 (1)请参考下述数据填空和回答问题: 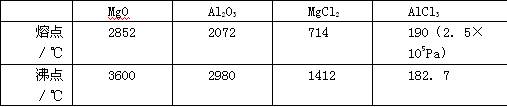 工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因 ;不用电解AlCl3的方法生产铝的原因 。 (2)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。  (3)写出Cu+的核外电子排布式 。 (4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。 (5)某喹喏酮类药物(中心离子是Cu2+)结构如下图,关于该药物的说法正确的是 。 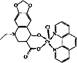 A.中心离子Cu2+的配位数是5 B.N原子均采用sp2杂化 C.存在配位键、极性共价键和非极性共价键 D.熔点很高,硬度很大 B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验: 步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。  步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10% 碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。 步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。 测定过程中发生的相关反应如下: ① 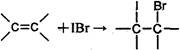 ②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62- 请回答下列问题: (1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是 ,碘瓶不干燥会发生反应的化学方程式 。 (2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是 。 (3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。 (4)反应结束后从液体混合物中回收四氯化碳,所需操作有 。 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |