I.设反应①Fe(s)+CO
2(g)?FeO(s)+CO(g)的平衡常数为K
1.反应 ②Fe(s)+H
2O(g)?FeO(s)+H
2(g)的平衡常数为K
2,在不同温度下,K
1、K
2的值如下:
| T(K) |
K1 |
K2 |
| 973 |
1.47 |
2.36 |
| 1173 |
2.15 |
1.67 |
(1)现有反应③CO
2(g)+H
2(g)?CO(g)+H
2O(g),这是一个
(填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(2)若反应Fe(s)+CO
2(g)?FeO(s)+CO(g)在温度T
1下进行;Fe(s)+H
2O(g)?FeO(s)+H
2(g)在温度T
2下进行,已知T
1>T
2,且c(CO
2)>c(H
2O)(其他条件均相同),则两者的反应速率
(填序号).
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法.请配平主要反应的方程式:
Na
2FeO
2+
NaNO
2+
H
2O═
NaFeO
2+
NH
3↑+
NaOH
(2)钢铁经冷、浓HNO
3处理后“钝化”能达到防腐目的,不同浓度的HNO
3与铁反应的还原产物很复杂,其分布曲线如下图.
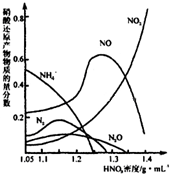
①图示可知,分析HNO
3与铁反应的规律是
.
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是
.
(3)金属(M)的腐蚀是因为发生反应:M-ne
-→M
n+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是
(填字母编号)
A.在铁中掺入铬等金属制成不锈钢 B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁 D.将水库铁闸门与直流电源的负极相连.


 和
和 ;“双烯合成反应”又称为“Diels-Alder反应”,如:
;“双烯合成反应”又称为“Diels-Alder反应”,如: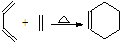 .
. ,则物质A的结构式为:
,则物质A的结构式为: 或CH2=CH-COOH
或CH2=CH-COOH 或CH2=CH-COOH
或CH2=CH-COOH

 中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为:
中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为:



 和
和 都是无色液体,下列物质中可以用来鉴别这两种物质的是
都是无色液体,下列物质中可以用来鉴别这两种物质的是