
题目列表(包括答案和解析)
(1)写出电解饱和氯化钠溶液时的电极反应式和总的离子反应方程式。?
阳极: ,阴极: ;?
总反应方程式: 。?
(2)离子交换膜电解槽一般采用金属钛作阳极,其原因是 ,阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是 。
(3)为使电解氯化钠的速率加快,下列措施可行的是 。
a.增大阴极碳钢网面积 b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离 d.提高电解时的电源电压?
(4)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO2-4等杂质离子,使用的试剂有:?a.Na2CO3?溶液; b.Ba(OH)2溶液; c.稀盐酸。其合理的加入顺序为 (填试剂序号)。
(5)如果在容积为10 L的离子交换膜电解槽中,1 min在阴极可产生11.2 L(标准状况)Cl2,这时溶液的pH是(设体积维持不变) 。?
(6)Cl2常用于自来水的消毒杀菌,现在有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需用Cl2和ClO2的物质的量之比为 。?
(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。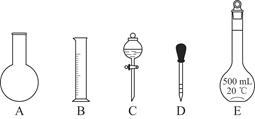
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为________g。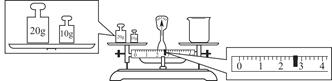
④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_____________________________________________。
(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
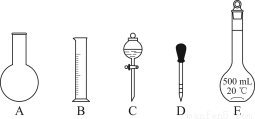
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为________g。
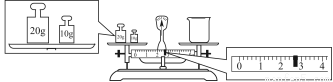
④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com