
题目列表(包括答案和解析)
碳酸氢铵是一种重要的铵盐。实验室中,将二氧化碳通入氨水可制得碳酸氢铵,用碳酸氢铵和氯化钠可制得纯碱。
完成下列填空:
41.二氧化碳通入氨水的过程中,先有__晶体(填写化学式)析出,然后晶体溶解,最后析出NH4HCO3晶体。
42.含0.800 mol NH3的水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.2g,则NH4HCO3的产率为____%。
43.粗盐(含Ca2+、Mg2+)经提纯后,加入碳酸氢铵可制得碳酸钠。实验步骤依次为:
①粗盐溶解;②加入试剂至沉淀完全,煮沸;③__;④加入盐酸调pH;⑤加入__;⑥过滤;⑦灼烧,冷却,称重。
44.上述步骤②中所加入的试剂为__、__。
45.上述步骤④中加盐酸调pH的目的是__。
46.为探究NH4HCO3和NaOH的反应,设计实验方案如下:
含0.1 mol NH4HCO3的溶液中加入0.1 mol NaOH,反应完全后,滴加氯化钙稀溶液。
若有沉淀,则NH4HCO3与NaOH的反应可能为_____(写离子方程式);
若无沉淀,则NH4HCO3与NaOH的反应可能为______(写离子方程式)。
该实验方案有无不妥之处?若有,提出修正意见。
碳酸氢铵是一种重要的铵盐.实验室中,将二氧化碳通入氨水可制得碳酸氢铵,用碳酸氢铵和氯化钠可制得纯碱.
完成下列填空:
1.二氧化碳通入氨水的过程中,先有________晶体(填写化学式)析出,然后晶体溶解,最后析出NH4HCO3晶体.
2.含0.800 mol NH3的水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.2 g,则NH4HCO3的产率为________%.
3.粗盐(含Ca2+、Mg2+)经提纯后,加入碳酸氢铵可制得碳酸钠.实验步骤依次为:
①粗盐溶解;②加入试剂至沉淀完全,煮沸;③________;④加入盐酸调pH;⑤加入________;⑥过滤;⑦灼烧,冷却,称重.
4.上述步骤②中所加入的试剂为________、________.
5.上述步骤④中加盐酸调pH的目的是________.
6.为探究NH4HCO3和NaOH的反应,设计实验方案如下:
含0.1 mol NH4HCO3的溶液中加入0.1 mol NaOH,反应完全后,滴加氯化钙稀溶液.
若有沉淀,则NH4HCO3与NaOH的反应可能为________(写离子方程式);
若无沉淀,则NH4HCO3与NaOH的反应可能为________(写离子方程式).
该实验方案有无不妥之处?若有,提出修正意见.
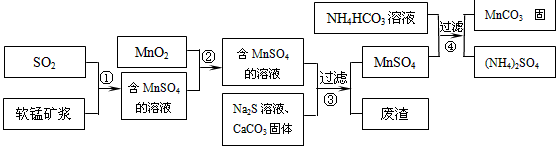
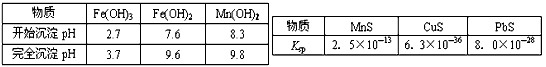
将碳酸氢铵在试管中加热,使放出的气体依次通过盛有足量过氧化钠、氯化钙的容器,最后得到的气体是
[ ]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com