铬是一种银白色的坚硬金属.铬的工业用途很广,主要有金属加工、电镀、制革行业,这些行业排放的废水和废气是环境中的主要污染源.请回答下面与铬有关的一些问题.
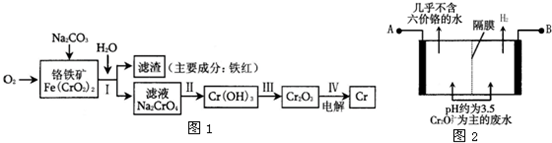
(1)工业上冶炼铬的主要步骤如图1所示:
①已知步骤Ⅱ的反应方程式为:
8Na
2CrO
4+6Na
2S+23H
2O═8Cr(OH)
3↓+3Na
2S
2O
3+22NaOH
该反应中每生成lmol Cr(OH)
3时转移电子的物质的量为______mol;
②步骤IV中电解Cr
2O
3的阳极反应式为______.
(2)某工厂采用电解法处理含铬废水.耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,其原理示意图如图2.阳极区溶液中发生的氧化还原反应为:______.
(3)重铬酸铵[(NH
4)
2Cr
2O
7]是一种桔黄色结晶,可用作实验室制备纯净的N
2及Cr
2O
3等.实验室可由工业级铬酸钠(Na
2CrO
4)为原料制取重铬酸铵.实验步骤如下:
步骤1:将铬酸钠溶于适量水中,加一定量浓硫酸酸化,使铬酸钠转化为重铬酸钠.
步骤2:先将上述溶液蒸发结晶并趁热过滤,继续将得到的晶体再溶解再蒸发结晶并趁热过滤.然后将得到的滤液冷却至40℃左右进行结晶,用水洗涤,获得重铬酸钠晶体.
步骤3:将得到的重铬酸钠和氯化铵按物质的量之比1:2溶于适量的水,加热至105~110℃时让其充分反应.
①步骤1是一个可逆反应,该反应的离子方程式为:______.
②(NH
4)
2Cr
2O
7受热分解制取N
2及Cr
2O
3的化学方程式为:______.
③为了测定实验制得的产品中(NH
4)
2Cr
2O
7的含量,称取样品0.140g置于锥形瓶中,加50mL水;再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min;然后加150mL蒸馏水并加入3mL0.5%淀粉溶液;用0.1000mol/LNa
2S
2O
3标准溶液滴定至终点,消耗Na
2S
2O
3标准溶液30.00mL.则该产品中(NH
4)
2Cr
2O
7的纯度为.(假定杂质不参加反应,已知:Cr
2O
72-+6I
-+14H
+═2Cr
3++3I
2+7H
2O,I
2+2S
2O
32-═2I
-+S
4O
62-)

