
题目列表(包括答案和解析)

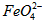 与水反应的化学方程式:
与水反应的化学方程式: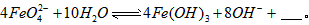
 在处理水的过程中所起的作用是____________和_____________。
在处理水的过程中所起的作用是____________和_____________。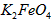 配制成c(
配制成c(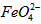 )=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(
)=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(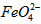 )的变化,结果见图I。第(1)题中的反应为
)的变化,结果见图I。第(1)题中的反应为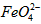 的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。
的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。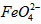 在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。 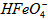 的分布分数先增大后减小
的分布分数先增大后减小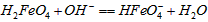
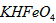 稀溶液加入水的过程中,pH可能增大也可能减小
稀溶液加入水的过程中,pH可能增大也可能减小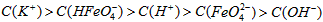
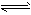 Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数
Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( )
A、2 B、3 C、4 D、5
Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq),在常温下
Cu2+(aq)+2OH-(aq),在常温下
Ksp=2×10-20mol3·L-3。某CuSO4溶液中,c(Cu2+)=0.02mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调整溶液的pH,使溶液的pH大于
A.2 B.3 C.4 D.5
Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( )
| A.2 | B.3 | C.4 | D.5 |
(1)已知NaA水溶液呈碱性,常温下将0.10 mol NaA和0.05 mol HCl溶于水,得到
①已知该混合溶液为弱酸性,则溶液中各离子浓度由大到小的顺序为_________________。
②向上述混合溶液中再加入0.03 mol NaOH,溶液中n(A-)+n(OH-)-n(H+)= ______mol。
(2)二氧化碳在水中除了存在H2CO3和![]() 的电离平衡外,还存在着如下平衡:
的电离平衡外,还存在着如下平衡:
CO2(g)![]() CO2(aq);CO2(aq)+H2O
CO2(aq);CO2(aq)+H2O![]() H2CO3(aq)。人体血液的pH通常稳定在7.35—7.45之间,这是多种因素共同作用的结果。其中,血液里存在的H2CO3—NaHCO3环境是血液pH保持稳定的重要因素,据此回答:
H2CO3(aq)。人体血液的pH通常稳定在7.35—7.45之间,这是多种因素共同作用的结果。其中,血液里存在的H2CO3—NaHCO3环境是血液pH保持稳定的重要因素,据此回答:
①当c(H+)增大时,血液中消耗H+的离子方程式为___________________;
②当c(OH-)增大时,血液的pH也能保持基本稳定,试结合电离方程式简要说明。_________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com