
题目列表(包括答案和解析)
某地的酸雨中,含c(Na+)=7.0×10-6mol·L-1,c(Cl-)=3.5×10-5mol·L-1,c(![]() )=2.3×10-5mol·L-1,c(
)=2.3×10-5mol·L-1,c(![]() )=2.5×10-6mol·L-1,则该地酸雨的pH为
)=2.5×10-6mol·L-1,则该地酸雨的pH为
[ ]
室温下,在pH=12的某溶液中,由水电离的c(OH-)为( )
A、1.0×10-2mol·L-1 B、5.0×10-2mol·L-1
C、1.0×10-6mol·L-1 D、5.0×10-12mol·L-1
25℃时,50 mL 0.1 mol/L醋酸中存在下述平衡:________.若分别作如下改变,对上述平衡有何影响?
(1)加入少量冰醋酸,平衡将________,溶液中c(H+)将________(增大、减小、不变);
(2)加入一定量蒸馏水,平衡将________,溶液中c(H+)将________(增大、减小、不变)
(3)加入少量0.1 mol/L盐酸,平衡将________,溶液中c(H+)将________(增大、减小、不变)
(4)加入20 mL 0.10 mol/L NaCl,平衡将________,溶液中c(H+)将________(增大、减小、不变)
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料.
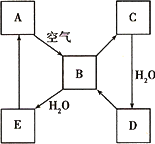
(1)写出A在加热条件下与H2反应的化学方程式________.
(2)写出E与A的氢化物反应生成A的化学方程式________.
(3)写出一个由D生成B的化学方程式________.
(4)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合.
①写出反应的离子方程式________;
②反应后溶液的pH________7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________.
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料.
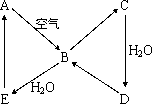
(1)写出A在加热条件下与H2反应的化学方程式________;
(2)写出E与A的氢化物反应生成A的化学方程式________;
(3)写出一个由D生成B的化学方程式________;
(4)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合.
①写出反应的离子方程式________;
②反应后溶液的pH________7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com