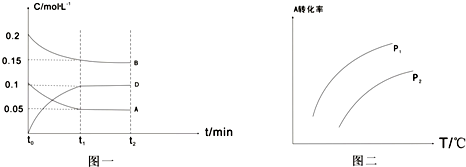
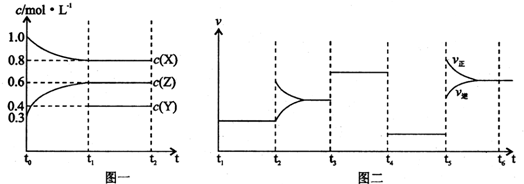
向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如附图一所示.附图二为t
2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t
3-t
4阶段为使用催化剂;图一中t
0-t
1阶段c(B)未画出.

(1)若t
1=15min,则t
0-t
1阶段以C浓度变化表示的反应速率为v(C)=
0.02mol/(L?min)
0.02mol/(L?min)
.
(2)t
4-t
5阶段改变的条件为
减小压强
减小压强
,B的起始物质的量为
1.0mol
1.0mol
.各阶段平衡时对应的平衡常数如下表所示:
| t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
| K1 |
K2 |
K3 |
K4 |
K5 |
K
1、K
2、K
3、K
4、K
5之间的关系为
K1=K2=K3=K4<K5
K1=K2=K3=K4<K5
求出K
1(写过程).
(3)t
5-t
6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
2A(g)+B(g)

3C(g)△H=+200akJ/mol
2A(g)+B(g)

3C(g)△H=+200akJ/mol
.
(4)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t
1时刻同样的平衡,a、b、c要满足的条件为
.

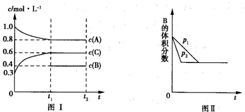 向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质的物质的量浓度随时间变化的曲线如图Ⅰ所示.若保持其他条件不变,压强分别为p1和p2时,B的体积分数与时间的关系曲线如图Ⅱ所示.下列结论正确的是( )
向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质的物质的量浓度随时间变化的曲线如图Ⅰ所示.若保持其他条件不变,压强分别为p1和p2时,B的体积分数与时间的关系曲线如图Ⅱ所示.下列结论正确的是( )
 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol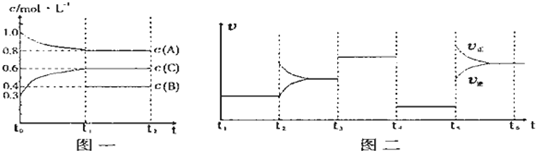
 3C(g)
3C(g) 3C(g)
3C(g)