
题目列表(包括答案和解析)
P4+3KOH+3H2O![]() PH3↑+3KH2PO2
PH3↑+3KH2PO2
被氧化的P与被还原的P的质量之比为
A.1∶2 B.2∶
(08福建省质检)黄磷(P4)与浓氢氧化钾溶液反应的化学方程式为:
P4 + 3KOH + 3H2O ![]() PH3↑+ 3KH2PO2
PH3↑+ 3KH2PO2
被氧化的P与被还原的P的质量之比为( )
A.1∶2 B.2∶1
C.3∶1 D.1∶3
 PH3↑+3KH2PO2,被氧化的P 与被还原的P的质量之比为
PH3↑+3KH2PO2,被氧化的P 与被还原的P的质量之比为[ ]
|
黄磷(P4)与浓氢氧化钾溶液反应的化学方程式为:P4+3KOH+3H2O | |
| [ ] | |
A. |
1∶2 |
B. |
2∶1 |
C. |
3∶1 |
D. |
1∶3 |
| 3 |
| 2 |
| 1 |
| 3 |
| 2 |
| 3 |
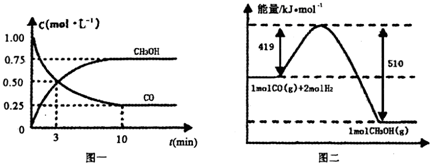
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com