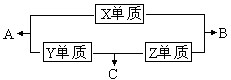
X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
已知一个B分子中含有的Z元素的原子个数比一个C分子中少一个.而W的单质在常温常压下为固体,并且W元素是形成化合物种类最多的元素.请回答下列问题:
(1)元素X在周期表中的位置
第2周期第ⅥA族
第2周期第ⅥA族
,Y单质的电子式
.
(2)化合物C在一定条件下生成化合物A的化学方程式
.
(3)常温下,将C通入元素Y的最高价氧化物的水化物的水溶液中,恰好完全反应时溶液呈
酸
酸
性(填“酸”、“碱”、“中”);此时溶液中离子浓度由大到小的顺序为
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.
(4)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为
NH
4++HCO
3-+2OH
-NH
3↑+2H
2O+CO
32-NH
4++HCO
3-+2OH
-NH
3↑+2H
2O+CO
32-.
(5)由X、Z、W三种元素可以形成化合物W
2Z
6X,其蒸汽通过灼热的氧化铜,黑色的氧化铜会逐渐变红,则该反应的化学方程式为
CH
3CH
2OH+CuO
CH
2CHO+Cu+H
2O
CH
3CH
2OH+CuO
CH
2CHO+Cu+H
2O
.

 X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
