
题目列表(包括答案和解析)
(选做题)(19分)图表法、模型法是常用的科学研究方法。
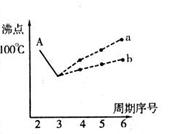
I.下图是研究部分元素的氢化物的沸点变化规律的图像。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b(其中A点对应的沸点是100℃),你认为正确的是 ,理由是 。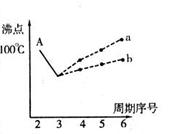
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为 。
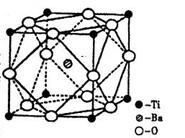
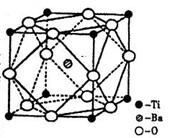
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,价电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。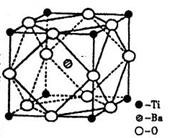
III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
(1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置 。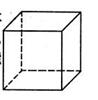
(2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物,
其可能原因是 (填字母代号)
| A.氙的含量比较丰富 | B.氙的相对原子质量大 |
| C.氙原子半径大,电离能小 | D.氙原子半径小,电负性大 |
(选做题)图表法、模型法是常用的科学研究方法。
I.下图是研究部分元素的氢化物的沸点变化规律的图像。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b(其中A点对应的沸点是100℃),你认为正确的是 ,理由是 。
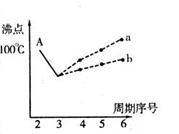
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,价电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。
III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
(1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置 。
(2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物,
其可能原因是 (填字母代号)
A.氙的含量比较丰富 B.氙的相对原子质量大
C.氙原子半径大,电离能小 D.氙原子半径小,电负性大
(3)已知XeO3分子中氙原子上有1对弧对电子,则XeO3为 分子(填“极性”或“非极性”)。

| A.氙的含量比较丰富 | B.氙的相对原子质量大 |
| C.氙原子半径大,电离能小 | D.氙原子半径小,电负性大 |
(I)多项选择题
下列说法中正确的是 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.SO3与CO32-互为等电子体,SO3是极性分子
(II)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ,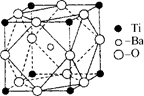
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是 晶体。
4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体。
(Ⅲ)
(1)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取 杂化。
(2)R是1~36
号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系: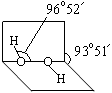
R3+ 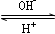 R(OH)3
R(OH)3 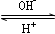 [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为 ;
②[R(OH)4]-中存在的化学键是 。
A.离子键 B.极性键 C.非极性键 D.配位键


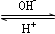 R(OH)3
R(OH)3 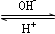 [R(OH)4]-
[R(OH)4]-湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com