
题目列表(包括答案和解析)
| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2(2 Na2CO3?3 H2O2 )=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解;Ⅰ、制备研究:如图1是制备过碳酸钠的工艺流程.  请回答问题: (1)反应器中发生反应的化学方程式为 2Na2CO3+3H2O2═2Na2CO3?3H2O2 2Na2CO3+3H2O2═2Na2CO3?3H2O2 ;(2)生产中,反应及干燥均需在较低温度下进行,原因是 防止过碳酸钠分解,影响产量和产率 防止过碳酸钠分解,影响产量和产率 ;(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为 过碳酸钠在NaCl溶液中溶解度较小,易析出晶体 过碳酸钠在NaCl溶液中溶解度较小,易析出晶体 .(4)操作A的名称是 过滤 过滤 ,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒 玻璃棒 和漏斗 漏斗 ;(5)洗涤过碳酸钠晶体最好选用 B B .A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液 (6)母液可以循环使用,其中主要含有的溶质是 NaCl NaCl 和Na2CO3(或H2O2) Na2CO3(或H2O2) ;Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数. 小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验. [实验步骤]:① 检查气密性 检查气密性 ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中不再产生气体 不再产生气体 时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.[实验分析及数据处理]: (7)完善实验步骤的相关内容:① 检查气密性 检查气密性 、④不再产生气体 不再产生气体 ;(8)实验中,水的作用是 溶解过碳酸钠,利于其分解 溶解过碳酸钠,利于其分解 ;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是MnO2(或CuO) MnO2(或CuO) (填化学式);(9)实验中, A A ,则开始收集气体;A.刚开始出现气泡时 B.当气泡均匀连续出现时 C.若用带火星木条放在导管口部,复燃时 (10)若量筒中收集到气体的体积是224mL(通常情况下,氧气的密度近似为1.43g?L-1.),计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr(2Na2CO3?3H2O2)=314、Mr(O2)=32] 95% 95% ;[实验反思]: (11)经过讨论,小组同学一致认为测定结果偏大,可能原因是 滴入的水占据了锥形瓶内的体积,使得O2体积偏大 滴入的水占据了锥形瓶内的体积,使得O2体积偏大 ;(12)量筒中长导管的作用是 起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸) 起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸) ;(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由. 不正确,装置中原有空气和生成的O2等体积代换 不正确,装置中原有空气和生成的O2等体积代换 ;(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为 93.6% 93.6% .(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数? 想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定 想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定 .(只需给出简要的方案)
氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂. [资料在线] Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体. Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气. Ⅲ.用氢气与金属钙加热的方法可制得氢化钙. Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝. [探究一:定性分析] (1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气 你支持________(填“甲”、“乙”)观点,理由是________. (2)CaH2中氢元素的化合价是________,写出CaH2与水反应的化学方程式________; (3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是________; (4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图. 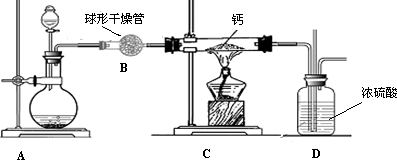
装置A中装有锌粒和稀硫酸,请写出其反应的化学方程式________,装置B中装有无水氯化钙,其作用是________,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接下图中的哪个装置:________(填①或②),现象是________. 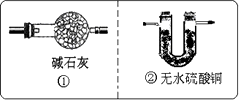
(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确________(填“是”或“否”);原因是________. [探究二:产物定量测定] 测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法. (1)取氢化钙样品与水反应,利用下图装置测定生成的气体体积时,在________即进行收集(填字母).
A.气泡连续均匀时 B.刚开始有气泡时 (2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用下图装置测定气体体积.该装置的优点是________,如何实现A中的水与B中样品接触而发生反应________.
(3)称取46 mg所制得的氢化钙样品,注射器D开始时活塞停留在10 mL刻度处,反应结束后充分冷却,活塞最终停留57.04 mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是________.(设该条件下每11.2 mL氢气的质量为1 mg) [反思提高] (1)上述实验在学校的实验室内,通过托盘天平等称量工具________(填“能”、“不能”)完成. (2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏________.
氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂. 【资料在线】 Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体. Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气. Ⅲ.用氢气与金属钙加热的方法可制得氢化钙. Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝. 探究一:定性分析 (1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气你支持______(填“甲”、“乙”)观点,理由是______. (2)CaH2中氢元素的化合价是______,写出CaH2与水反应的化学方程式______; (3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是______; (4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图. 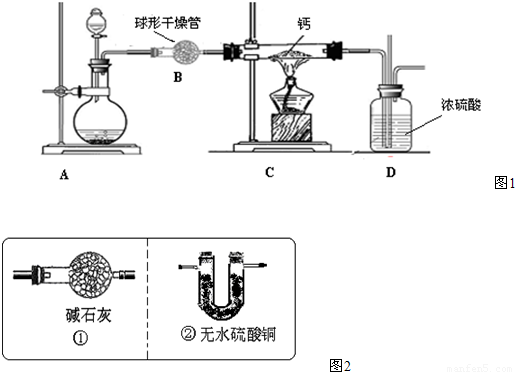 装置A 中装有锌粒和稀硫酸,请写出其反应的化学方程式______,装置B 中装有无水氯化钙,其作用是______,若要证明进入C 装置中的氢气已经干燥,在B、C之间应连接下图中的哪个装置:______(填①或②),现象是______. (5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确______(填“是”或“否”);原因是______. 探究二:产物定量测定 测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法. (1)取氢化钙样品与水反应,利用图1装置测定生成的气体体积时,在______即进行收集(填字母). A.气泡连续均匀时 B.刚开始有气泡时 (2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用图2装置测定气体体积.该装置的优点是______,如何实现A中的水与B中样品接触而发生反应______. 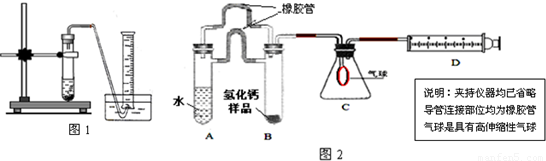 (3)称取46mg 所制得的氢化钙样品,注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是______.(设该条件下每11.2mL氢气的质量为1mg) 反思提高: (1)上述实验在学校的实验室内,通过托盘天平等称量工具______(填“能”、“不能”)完成. (2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏______. 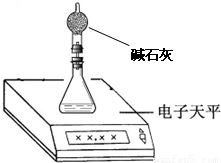 氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂. 【资料在线】 Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体. Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气. Ⅲ.用氢气与金属钙加热的方法可制得氢化钙. Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝. 探究一:定性分析 (1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气你支持______(填“甲”、“乙”)观点,理由是______. (2)CaH2中氢元素的化合价是______,写出CaH2与水反应的化学方程式______; (3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是______; (4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图.  装置A 中装有锌粒和稀硫酸,请写出其反应的化学方程式______,装置B 中装有无水氯化钙,其作用是______,若要证明进入C 装置中的氢气已经干燥,在B、C之间应连接下图中的哪个装置:______(填①或②),现象是______. (5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确______(填“是”或“否”);原因是______. 探究二:产物定量测定 测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法. (1)取氢化钙样品与水反应,利用图1装置测定生成的气体体积时,在______即进行收集(填字母). A.气泡连续均匀时 B.刚开始有气泡时 (2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用图2装置测定气体体积.该装置的优点是______,如何实现A中的水与B中样品接触而发生反应______. 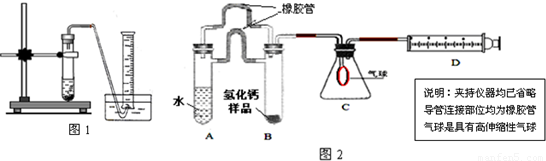 (3)称取46mg 所制得的氢化钙样品,注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是______.(设该条件下每11.2mL氢气的质量为1mg) 反思提高: (1)上述实验在学校的实验室内,通过托盘天平等称量工具______(填“能”、“不能”)完成. (2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏______.  镁合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水提镁是国际上的主要趋势,工业流程图如下:
其步骤为: I.将海边大量存在的贝壳(主要成分为CaCO3煅烧成生石灰,并将生石灰制成石灰乳 Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀 Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O Ⅳ.将MgCl2·6H2O在一定条件下加热得到无水MgCl2 V.电解熔融的无水MgCl2可得到Mg(1)请根据上述步骤回答问题: ①写出步骤I、Ⅲ的有关化学方程式: I.贝壳煅烧成生石灰 ; Ⅲ.Mg(OH)2沉淀中加入盐酸中和 。 ②步骤I~V中有分解反应的是(填写步骤序号): 。 ③步骤11中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发需要的主要仪器有 、 、酒精灯、带铁圈的铁架台、坩埚钳等。 ④上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?请写出其中一点: 。 (2)回答下列问题: ①右图为镁元素的某种粒子结构示意图,该图表示(填序号)
A.分子 B.原子 C.阳离子D.阴离子. ②镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或”不活泼”) 金属,除了能与氧气反应,还可以与氮气、二氧化碳等反应。
讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是 。 讨论二:若用空气代替O2进行实验,对测定结果(填“有”或“无”) 影响。 ②第二小组设计下列实验方案:称取b g镁铝合金,与足量的稀盐酸完全反应。 欲计算镁的质量分数,该实验中还需测定的一种数据是 。 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |