
题目列表(包括答案和解析)
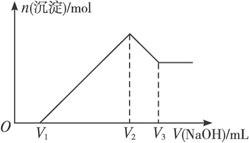
图11-1
(1)最初加入V1 mL NaOH溶液的作用是__________________________________________。
(2)盐酸的物质的量浓度是___________________________。
(3)若m g混合物中Al2O3与Fe2O3按不同比例进行上述实验(其他条件不变),则V2的值改变________(填“会”或“不会”),(V2-V1)的取值范围是_________________________。
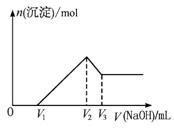
图1-3-17
若保持混合物总质量不变,Al2O3与Fe2O3按不同比例混合进行上述实验(其他条件不变),当![]() 变大时,关于V1、V2、V3的变化的判断正确的是( )
变大时,关于V1、V2、V3的变化的判断正确的是( )
A.V1变大 B.V2不变 C.V3变小 D.(V3-V1)不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com