
题目列表(包括答案和解析)
| 实验现象 | 结论及解释 | |
| ①将铁钉(足量)加入烧瓶中,再向其中滴加含amolH2SO4的浓硫酸溶液 | 未见明显现象 | 原因: 。 |
| ②点燃A、G处酒精灯 | 片刻后,烧瓶中溶液的颜色发生变化,并有气泡产生。C中溶液颜色 ,E中溶液未见明显变化。一段时间后,黑色的CuO变成了红色,此时E装置溶液颜色仍未有颜色变化 | 烧瓶中发生的所有反应 的化学方程式: 说明产生的SO2气体完全被D中溶液吸收 |
(1)将漂粉精溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为____________________。另取少许上层清液,先滴加适量的_________ (填化学式)酸化,再滴加_________(填化学式)溶液即可检验Cl-的存在,发生反应的离子方程式为____________________。再取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂粉精溶液呈__________性并具有__________性。
(2)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl====2Cl2↑+CaCl2+2H2O
该反应中,每生成1 mol Cl2,转移电子物质的量为__________,被氧化的HCl的物质的量为__________。
有效氯是漂粉精中有效成分Ca(ClO)2的含量大小标志,已知:有效氯
=![]() ×100%
×100%
若某漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数=___________。
(计算结果保留小数点后1位。已知相对分子质量用Mr表示:Mr(Cl2)=71,Mr[Ca(ClO)2]=143)
(3)现用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂粉精,甲、乙、丙三人分别设计三个实验装置,如图1-3-1所示。已知Cl2与Ca(OH)2制漂粉精的反应是放热反应,而在较高温度下即发生如下反应:
6Cl2+6Ca(OH)2====5CaCl2+Ca(ClO3)2+6H2O

图1-3-1
①请指出三个装置各自的缺点或错误(如没有可不填):
甲____________________________________________________________,
乙____________________________________________________________,
丙____________________________________________________________。
②图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置__________ (填所选部分的编号)。
③实验中若用100 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15 mol,其可能的主要原因是____________________ (假定各步反应均无反应损耗且无副反应发生)。
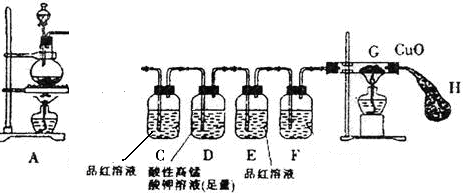
某研究小组按图示方向将A装置与下面所示装置相连,设计实验,研究铁与浓硫酸的反应。请你帮助完成下列实验报告,并回答有关问题。
| 实验步骤 | 实验现象 | 结论及解释 |
| ①将铁钉(足量)加入烧瓶中,再向其中滴加含amolH2SO4的浓硫酸溶液 | 未见明显现象 | 原因: 。 |
| ②点燃A、G处酒精灯 | 片刻后,烧瓶中溶液的颜色发生变化,并有气泡产生。C中溶液颜色 ,E中溶液未见明显变化。一段时间后,黑色的CuO变成了红色,此时E装置溶液颜色仍未有颜色变化 | 烧瓶中发生的所有反应 的化学方程式:
说明产生的SO2气体完全被D中溶液吸收 |
填完上述实验报告并回答下列问题:
(1)连接好装置后,盛放药品前,首先要进行 操作。
(2)装置D的作用是 ,若现在实验室没有酸性高锰酸钾溶液,则D装置中的溶液可用 (填编号)代替
A、蒸馏水 B、浓硫酸 C、浓NaOH溶液 D、饱和NaHSO3溶液
(3)装置F中的溶液是 ,装置H的作用是:
(4)为了测定产生的SO2的量,实验后向烧瓶中加足量的盐酸至无气泡产生,再加足量的BaCl2溶液至沉淀完全,然后进行 、 、干燥、称量。为判断沉淀完全,应该进行的操作是: 。
(5)若(4)所得沉淀的质量为mg,则反应产生的SO2在标准状况的体积为:
L(列出计算式即可)
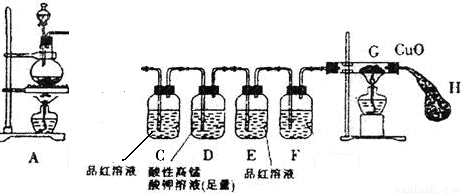
某研究小组按图示方向将A装置与下面所示装置相连,设计实验,研究铁与浓硫酸的反应。请你帮助完成下列实验报告,并回答有关问题。
|
实验步骤 |
实验现象 |
结论及解释 |
|
①将铁钉(足量)加入烧瓶中,再向其中滴加含amolH2SO4的浓硫酸溶液 |
未见明显现象 |
原因: 。 |
|
②点燃A、G处酒精灯 |
片刻后,烧瓶中溶液的颜色发生变化,并有气泡产生。C中溶液颜色 ,E中溶液未见明显变化。一段时间后,黑色的CuO变成了红色,此时E装置溶液颜色仍未有颜色变化 |
烧瓶中发生的所有反应 的化学方程式:
说明产生的SO2气体完全被D中溶液吸收 |
填完上述实验报告并回答下列问题:
(1)连接好装置后,盛放药品前,首先要进行 操作。
(2)装置D的作用是 ,若现在实验室没有酸性高锰酸钾溶液,则D装置中的溶液可用 (填编号)代替
A、蒸馏水 B、浓硫酸 C、浓NaOH溶液 D、饱和NaHSO3溶液
(3)装置F中的溶液是 ,装置H的作用是:
(4)为了测定产生的SO2的量,实验后向烧瓶中加足量的盐酸至无气泡产生,再加足量的BaCl2溶液至沉淀完全,然后进行 、 、干燥、称量。为判断沉淀完全,应该进行的操作是: 。
(5)若(4)所得沉淀的质量为mg,则反应产生的SO2在标准状况的体积为:
L(列出计算式即可)
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ▲ ;砷与溴的第一电离能较大的是 ▲ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 ▲ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为 ▲ ,As原子采取 ▲ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 ▲ 个Ga相连,As与Ga之间存在的化学键有 ▲ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
B.某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下:

有关物质的部分物理性质如下:
|
| 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯甲醛 | —26 | 179 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 | 122 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 | -15.3 | 205.0 | 稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 | -116.2 | 34.5 | 微溶于水,易溶于乙醇 |
实验步骤:
(1)在250 mL锥形瓶中,放入9 g KOH和9 mL水,配成溶液,冷却至室温。加入10.5 g新蒸馏的苯甲醛,塞紧瓶塞,用力振荡,使之变成糊状物,放置24 h。
①苯甲醛要求新蒸馏的,否则会使 ▲ (填物质名称)的产量相对减少。
②用力振荡的目的是 ▲ 。
(2)分离苯甲醇
①向锥形瓶中加入30 mL水,搅拌,使之完全溶解。冷却后倒入分液漏斗中,用30 mL乙醚萃取苯甲醇(注意留好水层)。30 mL 乙醚分三次萃取的效果比一次萃取的效果 ▲ (填“好”或“差”)。
②将醚层依次用饱和亚硫酸氢钠溶液、饱和碳酸钠溶液和水各5 mL洗涤,再用无水硫酸镁干燥。将干燥后的乙醚溶液转移到100 mL蒸馏烧瓶中,投入沸石,连接好普通蒸馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代号)。
A.水浴加热 B.油浴加热 C.沙浴加热 D.用酒精灯直接加热
③改用空气冷凝管蒸馏,收集 ▲ ℃的馏分。
(3)制备苯甲酸
在乙醚萃取过的水溶液中,边搅拌边加入浓盐酸酸化至pH=3.5左右。冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com