
题目列表(包括答案和解析)
二氧化钛(TiO2)广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到胶体TiO2 ,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________ ;
②检验TiO2·x H2O中Cl-是否被除净的方法是______________________________
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
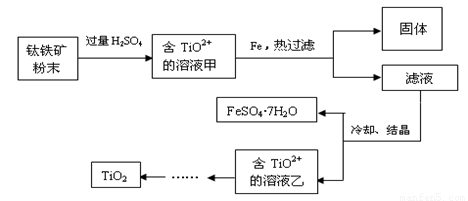
(2)钛铁矿粉末中加硫酸反应得TiO2+的离子方程式为
(3)溶液甲中加入Fe的作用是
(4)若要加热FeSO4.7H2O晶体得无水硫酸亚铁,除酒精灯、玻璃棒外,还要用到的两种硅酸盐质仪器是
Ⅱ二氧化钛可用于制取钛单质,涉及到的步骤如下图:
反应②的方程式是 ,该反应需要在Ar气氛中进行,请解释原因: _
二氧化钛(TiO2)广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到胶体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________ ;
②检验TiO2·x H2O中Cl-是否被除净的方法是______________________________
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
(2)钛铁矿粉末中加硫酸反应得TiO2+的离子方程式为
(3)溶液甲中加入Fe的作用是
(4)若要加热FeSO4.7H2O晶体得无水硫酸亚铁,除酒精灯、玻璃棒外,还要用到的两种硅酸盐质仪器是
Ⅱ二氧化钛可用于制取钛单质,涉及到的步骤如下图:
反应②的方程式是 ,该反应需要在Ar气氛中进行,请解释原因: _


| 实验步骤 | 实验现象 | 实验结论 |
| ①______ | ______ | 溶液X中含有钠离子 |
| ②______ | ______ | 溶液X中含有氯离子 |
二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。

(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为
![]()
![]()
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是 ,图示装置中缺少的一种必须的玻璃仪器是
②装置A用于溶解产生的二氧化氯气体,其中最好盛放 (填字母)。
A.20mL 60℃的温水 B.100mL冰水
C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(![]() )。饮用水中ClO2、
)。饮用水中ClO2、![]() 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:
![]()
![]() ,则步骤4中加入的指示剂为 ,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为 ,滴定达到终点时溶液的颜色变化为
③步骤5的目的是使![]() 将溶液中的
将溶液中的![]() 还原为
还原为![]() 以测定其含量,该反应的离子方程式为:
以测定其含量,该反应的离子方程式为:
④若饮用水中![]() 的含量超标,可向其中加入适量的
的含量超标,可向其中加入适量的![]() 将
将![]() 还原为
还原为![]() ,则该反应的氧化产物为 (填化学式)
,则该反应的氧化产物为 (填化学式)
(14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。

(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为


①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是 ,图示装置中缺少的一种必须的玻璃仪器是
②装置A用于溶解产生的二氧化氯气体,其中最好盛放 (填字母)。
A.20mL 60℃的温水 B.100mL冰水
C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(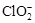 )。饮用水中ClO2、
)。饮用水中ClO2、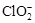 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:

 ,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
③步骤5的目的是使 将溶液中的
将溶液中的 还原为
还原为 以测定其含量,该反应的离子方程式为:
以测定其含量,该反应的离子方程式为:
④若饮用水中 的含量超标,可向其中加入适量的
的含量超标,可向其中加入适量的 将
将 还原为
还原为 ,则该反应的氧化产物为
(填化学式)
,则该反应的氧化产物为
(填化学式)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com