
题目列表(包括答案和解析)
对某酸性溶液(可能含有Br-,SO42-,NH4+,Cl-,H2SO3)分别进行如下实验,得到相应的实验事实:
①将溶液加热,产生能使品红溶液褪色的气体
②加足量烧碱溶液,加热时放出的气体可以使湿润的红色石蕊试纸变蓝。产生该气体的离子方程式为 。
③加入足量氯水时,溶液显橙黄色;再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
写出加入足量氯水时的离子反应方程式 ,
从以上实验事实,不能确认原溶液中是否存在的离子是 (选填序号)。
A Br- B SO42- C Cl- D NH4+
茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以测定某品牌茶叶中钙元素的质量分数并检验铁元素的存在(已知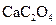 为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为::
| 离子 | 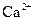 | 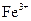 |
| 完全沉淀时的pH | 13 | 4.1 |
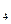 标准溶液滴定C溶液时所发生的反应为:
标准溶液滴定C溶液时所发生的反应为: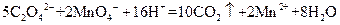 。
。
茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以测定某品牌茶叶中钙元素的质量分数并检验铁元素的存在(已知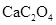 为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为::
| 离子 |
|
|
| 完全沉淀时的pH | 13 | 4.1 |
实验前要先将茶叶样品高温灼烧成灰粉,其主要目的是__________。
(2)写出从滤液A→沉淀D的离子反应方程式__________。
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试
判断沉淀D已经洗涤干净的方法是__________。
(4)用KMnO![]() 标准溶液滴定C溶液时所发生的反应为:
标准溶液滴定C溶液时所发生的反应为:
![]() 。
。
现将滤液C稀释至500 mL,再取其中的25.00 mL溶液,用硫酸酸化后,用0.1000
mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00 mL。
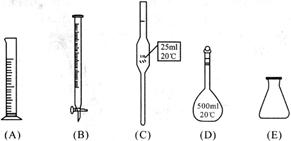
①此步操作过程中需要用到下列哪些仪器(填写序号)________;
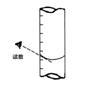
②达到滴定终点时,溶液的颜色变化是________;
③滴定到终点,静置后,如右图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将________(填“偏高”、“偏低”、“无影响”)。
(5)原茶叶中钙元素的质量分数为________。
(6)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是________。
茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以测定某品牌茶叶中钙元素的质量分数并检验铁元素的存在(已知![]() 为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
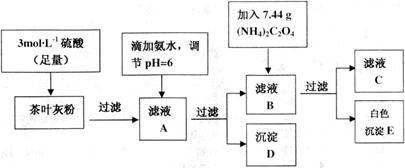
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为::
| 离子 |
|
|
| 完全沉淀时的pH | 13 | 4.1 |
实验前要先将茶叶样品高温灼烧成灰粉,其主要目的是__________。
(2)写出从滤液A→沉淀D的离子反应方程式__________。
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试
判断沉淀D已经洗涤干净的方法是__________。
(4)用KMnO![]() 标准溶液滴定C溶液时所发生的反应为:
标准溶液滴定C溶液时所发生的反应为:
![]() 。
。
现将滤液C稀释至500 mL,再取其中的25.00 mL溶液,用硫酸酸化后,用0.1000
mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00 mL。
①此步操作过程中需要用到下列哪些仪器(填写序号)________;
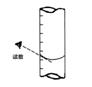
②达到滴定终点时,溶液的颜色变化是________;
③滴定到终点,静置后,如右图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将________ (填“偏高”、“偏低”、“无影响”)。
(5)原茶叶中钙元素的质量分数为________。
(6)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是________。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
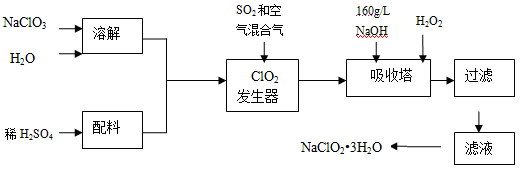
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的离子反应方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com