
题目列表(包括答案和解析)
常温下pH为2的盐酸,下列叙述正确的是
A.将10 mL该溶液稀释至100 mL后,pH小于3
B.向该溶液中加入等体积pH为12的氨水恰好完全中和
C.该溶液中由水电离出的c水(H+)·c水(OH-)=1×10-14
D.该溶液中盐酸电离的c(H+)与水电离出的c(H+)之比为1010∶1
下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-) =c(NH4+)
B.两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1<10c2
C.室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈酸性
D.向冰醋酸中逐渐加水,有如图变化:a、b、c三点中水的电离程度最大的是b点
下列叙述正确的是
A.将三氯化铁饱和溶液滴入沸水中,再加热几分钟后可得到氢氧化铁胶体
B.氢氧化铁胶体分散质能透过滤纸,也能透过半透膜
C.溶液和胶体的本质区别是可否发生丁达尔效应
D.将氢氧化钠溶液滴入三氯化铁溶液中可得到氢氧化铁胶体
25℃时,水中存在电离平衡:H2O 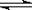 H++OH- ΔH>0。下列叙述正确的是
H++OH- ΔH>0。下列叙述正确的是
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变
C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大
下列叙述正确的是
A.将pH=2的盐酸和pH=2的醋酸等体积混合,混合后溶液的pH=2
B.HA-比HB-更难电离,则NaHA溶液的pH一定比NaHB溶液的大
C.在饱和氨水中加入同浓度的氨水,平衡正向移动
D.某温度下,Ba(OH)2溶液中,Kw=10-12,pH=8的该溶液中加入等体积pH=4的盐酸,混合溶液的pH=7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com