
题目列表(包括答案和解析)
物质结构与性质:等电子体原理是指两个或两个以上的分子(或离子),它们的原子数相同,分子(或离子)中价电子数也相同,这些分子(或离子)常具有相似的电子结构,相似的几何构型,而且有时在性质上也有许多相似之处.
(1)SiO32-、SO32-、NO3-三种离子是等电子体,三种离子的几何构型为________,其中Si、S、N三种基态原子的第一电离能大小关系为________.
(2)C2O42-和________是等电子体,C2O42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色,Mn原子在元素同期表中的位置是________,外围电子构型为________.
(3)二原子14电子的等电子体共同特点是物质中都具有共价叁键,请举出相应的3个例子________(可以是分子或离子).每个分子或离子中含________个σ键,________个π键.
(4)过去生产上常以SiO2为催化剂的载体,它和近十几年来应用日广的AlPO4是等电子体,在AlPO4中P为________配位氧.SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞,则一个硅的晶胞中有________个Si原子.再在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有________个Si原子,________个O原子.
随着世界杯足球赛的不断发展,人们对“足球”分子越来越感兴趣,读下列两则材料,回答相关问题:
材料一:科学家发现的C60是一种新的分子,它具有空心类似于足球的结构,分子中的每个碳原子只跟相邻的三个碳原子形成化学键,且分子中只含有五边形和六边形,被称为“分子足球”.1996年,某些国家的科研人员应用电子计算机将60个氮原子模拟成足球分子.结构表明:60个氮原子可以结合成与C60相似的足球状分子——N60,它与C60的结构相似,常温下能稳定存在,在高温或机械撞击时,其积蓄的巨大能量会一瞬间内释放出来,因而能用作单组分火箭的推进剂.
材料二:据某科学杂志报道,国外有一研究所发现了一种新的球形分子,它的分子式为C60Si60,它的分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构,硅原子与碳原子以共价键结合.
据上述材料下列说法正确的是________.
①N60与14N都是氮的同位素
②N60与C60互为同分异构体
③N60与N2互为同素异形体
④N60是共价化合物
⑤C60Si60是两种单质混合成类似于“合金”的混合物
⑥N60作火箭推进剂时发生了氧化还原反应
⑦N60分子中不含双键,C60Si60分子中也不含双键
⑧N60与C60Si60均是分子晶体
⑨N60具有较高硬度,而C60Si60硬度较小,熔点较低
⑩C60Si60分子中Si60被包裹在C60里面
(1)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化铝、硫化镉、硫化锌薄膜电池等.
①第一电离能:As________Se(填“>”、“<”或“=”).
②二氧化硒分子的空间构型为________.
③砷化铝晶体结构与硅相似,在砷化铝晶体中,每个Al原子与________个A s原子相连.
(2)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力,其中铜钙合金的晶胞结构如下图:试回答下列问题
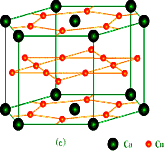
①在周期表中Ca处于周期表________区.
②铜原子的基态核外电子排布式为:________.
③已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n=________(填数值);氢在合金中的密度为:________.
(3)中美科学家合作发现钙和锶在C60上吸附很强,可以均匀地覆盖在C60表面上,形成M32C60.非常适于实际应用.Ca32C60上可吸附至少92个氢分子.有关说法正确的是________.
A.钙的电负性比锶的小
B.C60中碳原子杂化方式为sp3
C.Ca32C60储氢是与H2发生加成反应
D.吸附相同数目氢分子时,储氢质量分数Ca32C60比Sr32C60高
(15分)第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为 。
②下列叙述不正确的是 。(填字母)
A.因为HCHO为极性分子,水也为极性分子,根据相似相溶原理,HCHO易溶于水。
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②六氰合亚铁离子[Fe(CN)6]4 -中不存在 。
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
写出一种与 CN- 互为等电子体的单质分子式 。
(3)根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Ti属于 区。
(4)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:

① 确定该合金的化学式 。
② 若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
 键和1个大
键和1个大 键,C2H2是非极性分子
键,C2H2是非极性分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com