
题目列表(包括答案和解析)
(1)填空:
①pH=4
的CH3COOH溶液稀释100倍后所得溶液pH________6(填“>”或“<”或“=”);②0.01 mol/L CH3COOH
溶液的pH________2(填“>”或“<”或“=”);③0.1 mol/L CH3COONa
溶液的pH________7(填“>”或“<”或“=”);(2)观察比较以上三个小题,试推测证明某酸(HA)是弱电解质的原理可以有两个:
一是证明HA不能完全电离,溶液中存在________平衡;
二是证明HA与强碱生成的盐具有________性.
(3)请你根据以上原理提出两种方案,证明
CH3COOH是弱电解质,简要写出实验方案:①______________________;
②______________________
.(1)室温下PH=2的某强酸稀释100倍,PH=_____,PH=12的某强碱稀释100倍,PH=____
(2)室温下,PH=2的HCl与PH=12的氨水等积混合后,溶液的PH_ __7(填>,<或=),原因是 _______________________________________________________________________________
__7(填>,<或=),原因是 _______________________________________________________________________________
(3)室温下,0.01mol/L的HCl与0.01mol/L的氨水混合后,溶液的PH___7(填>,<或=),原因是_______________________________________________________________________
(4)室温下,将PH=5的H2SO4溶液稀释10倍C(H+):C(SO42-)=_________
将稀释后的溶液再稀释100倍,C(H+):C(SO42-)=_________
(5)MOH和ROH两种一元碱的水溶液分别加水稀释时,PH变化如右图:下列叙述中正确的是()
A:MOH是一种弱碱
B:在x点,MOH完全电离
C:在x点C(M+)=C(R+)
D:稀释前ROH溶液中C(OH-)是MOH溶液中C(OH-)的10倍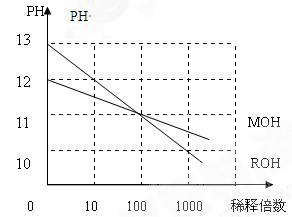
 __7(填>,<或=),原因是 _______________________________________________________________________________
__7(填>,<或=),原因是 _______________________________________________________________________________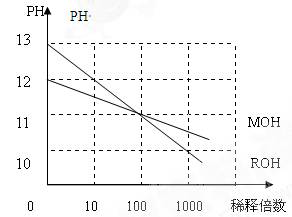
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com