
题目列表(包括答案和解析)
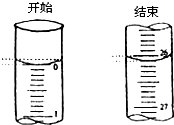 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(20分)某化学课外活动小组以铝屑、稀H2SO4、NaOH溶液为主要原料欲制备Al(OH)3沉淀,设计了如下三种方案,见下表。阅读下表并回答下列问题:
| 途径 | 生成1 mol Al(OH)3消耗H+或OH-的物质的量/mol | |
| 消耗H+ | 消耗OH- | |
| 1.Al→Al3+→Al(OH)3 | | |
2.Al→AlO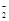 →Al(OH)3 →Al(OH)3 | | |
3.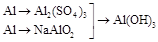 | | |
 (g)NaOH固体。他在托盘天平的右盘上放入(
(g)NaOH固体。他在托盘天平的右盘上放入(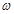 + y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________ 使 。
+ y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________ 使 。
 (g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。
(g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。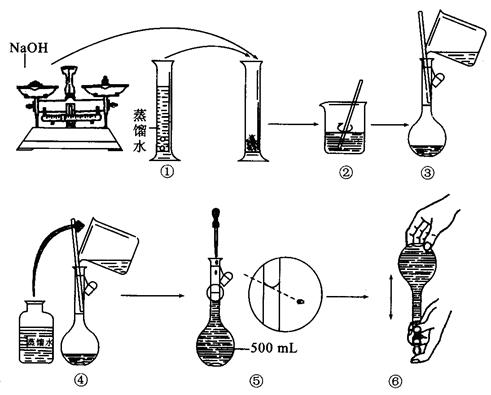
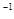 NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。
NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。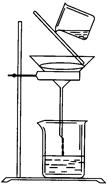
(20分)某化学课外活动小组以铝屑、稀H2SO4、NaOH溶液为主要原料欲制备Al(OH)3沉淀,设计了如下三种方案,见下表。阅读下表并回答下列问题:
|
途径 |
生成1 mol Al(OH)3消耗H+或OH-的物质的量/mol |
|
|
消耗H+ |
消耗OH- |
|
|
1.Al→Al3+→Al(OH)3 |
|
|
|
2.Al→AlO |
|
|
|
3. |
|
|
(1)填写上表中空格并从节约原料的角度来分析,你认为应选择方案_________最为合理。
(2)本实验要用到NaOH溶液。某学生用已知质量y(g)的表面皿,准确称取 (g)NaOH固体。他在托盘天平的右盘上放入(
(g)NaOH固体。他在托盘天平的右盘上放入( + y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________ 使
。
+ y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________ 使
。

(3)若称取的 (g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。
(g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。

(4)阅读下列制备Al(OH)3实验步骤,填写空白:
①在烧杯A中加入50mL0.5mol·L NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。
NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。
②在盛有适量稀H2SO4的烧杯B中应放入___________(g)(用含m1的式子表示)质量的铝屑,充分搅拌使铝屑反应完全。
③在盛有适量浓NaOH溶液的烧杯C中放入____________(g)(用含m1的式子表示)质量的铝屑充分搅拌使铝屑反应完全。
④将烧杯B和烧杯C中的溶液混和观察到的现象是:_______________________________,反应的离子方程式是:___________________________
(5)过滤时某学生操作如图,请用文字说明图中错误的是:
_____________________ 。

(6)把沉淀转移到烧杯中,用蒸馏水洗涤三次再过滤,再洗涤、
干燥得Al(OH)3固体质量为m2(g)计算本实验Al(OH)3的产率是_________________
(14分)(1)某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
①用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____ _。直到因加入一滴盐酸后,溶液由红色变为无色,并且__ _ 为止;
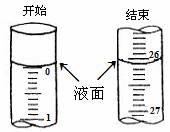
②若滴定开始和结束时,酸式滴定管中的液面如图所示:则所滴定盐酸的体积为_________mL;
(2)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净的玻璃棒蘸取试样进行检测。
①该学生的操作是 (正确或错误)。
 ②如不正确,请分析是否一定有误差,为什么? 。
②如不正确,请分析是否一定有误差,为什么? 。
③若用此法分别测定c(H+)相同的盐酸和醋酸的稀溶液的pH,误差较大的是 ___________,原因是 。
某学校化学课外小组用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题.
①应选择________作指示剂.
②为减小滴定误差,在选用盐酸的物质的量浓度和体积时,下列四个选项中最佳的是________(填选项字母)
(A)1 mol/L,50 mL
(B)0.20 mol/L,25 mL
(C)0.02 mol/L,5 mL
(D)5 mol/L,10 mL
③现有用浓盐酸新配制出的溶液,该盐酸在使用前,欲标定其准确的浓度,需用基准物进行标定.已知基准物是某些纯度高、稳定性好的物质,可在准确称量后直接配制成标准溶液并标定其它溶液的浓度.实验室标定标准的盐酸一般选用纯净的无水碳酸钠作基准物.上述基准物能否改用纯净的氢氧化钠固体?________(填“能”或“不能”);简述理由________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com