
题目列表(包括答案和解析)
下列叙述正确的是
| A.将5.85 g NaCl晶体溶入100 mL水中,制得0.10 mol/L的NaCl溶液 |
| B.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L |
C.将w g a%的NaCl溶液蒸发掉 g水,可得到2a%的NaCl溶液( g水,可得到2a%的NaCl溶液( >2a%) >2a%) |
| D.将1体积c1mol/L的硫酸用水稀释为5体积,所得稀溶液的浓度为0.2c1mol/L |
下列叙述正确的是
A.将5.85 g NaCl晶体溶入100 mL水中,制得0.10 mol/L的NaCl溶液
B.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L
C.将w g a%的NaCl溶液蒸发掉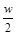 g水,可得到2a%的NaCl溶液(
g水,可得到2a%的NaCl溶液(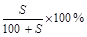 >2a%)
>2a%)
D.将1体积c1 mol/L的硫酸用水稀释为5体积,所得稀溶液的浓度为0.2c1 mol/L
| A.将5.85 g NaCl晶体溶入100 mL水中,制得0.10 mol/L的NaCl溶液 |
| B.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L |
C.将w g a%的NaCl溶液蒸发掉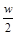 g水,可得到2a%的NaCl溶液( g水,可得到2a%的NaCl溶液(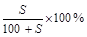 >2a%) >2a%) |
| D.将1体积c1mol/L的硫酸用水稀释为5体积,所得稀溶液的浓度为0.2c1mol/L |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com