(13分)已知某纯碱样品中含有少量氯化钠,为测定样品中纯碱的质量分数,甲、乙两组分别采用不同方法。
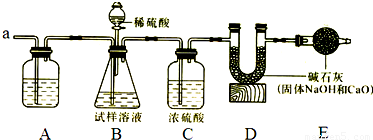
Ⅰ、甲组用下图装置通过测定气体质量再计算出纯碱的质量分数。
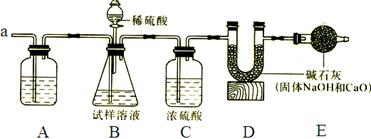
其主要步骤如下:
①按图组装仪器并检查气密性;
②称取m克试样放入锥形瓶中加适量蒸馏水使之完全溶解;
③称量装置D中装有碱石灰的U形管质量是a
1克;
④从分液漏斗中慢慢滴加20%的稀硫酸
⑤从导管a中缓缓鼓入空气;
⑥再次称量装置D中装有碱石灰的U形管质量;
⑦重复⑤和⑥的操作,直到装置D中U形管质量基本不变,测得质量为a
2克。
试回答相关问题:
⑴A装置中最好装______溶液,作用是________________________;
⑵装置C中浓硫酸的作用是_____________________________________;
(3)步骤④中,从分液漏斗中慢慢滴加20%的稀硫酸直至观察到_______为止,写出该反应的化学方程式______________________;
(4)若没有步骤⑤会使测定结果_______(偏大或偏小);
(5)E装置中碱石灰的作用是____________________________________________;
(6)装置B中分液漏斗内的稀硫酸不能换成浓盐酸的理由是__________________________。
Ⅱ、乙组用生成沉淀的方法来测定纯碱(Na
2CO
3)的质量分数,称取12.5克样品加入107.2克的氯化钡溶液恰好完全反应过滤得到的沉淀干燥后为19.7克和一定量滤液(设没有损失),试计算①样品中纯碱的质量分数;②滤液中溶质的质量分数。(写过程5分)