
题目列表(包括答案和解析)
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是
|
卡片号:2 2008.3.15,实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生 ③ ④若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤电子的流向是:Cu─→Zn ⑥正极反应式:Cu+2e-==Cu2+ |
A.①②③
B.②④
C.④⑤⑥
D.③④⑤
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
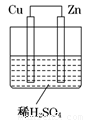
|
卡片号:2 2013.3.15,实验后的记录: ① Cu为负极,Zn为正极 ② Cu极上有气泡产生 ③ SO42– 向Cu极移动 ④ 若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤ 电子的流向是:Cu→Zn ⑥正极反应式:Cu +2e- = Cu2+ |
A.①②③ B.②④ C.④⑤⑥ D.③④⑤
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是
| 卡片号:2 2008.3.15,实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生 ③  向Cu极移动 向Cu极移动④若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤电子的流向是:Cu─→Zn ⑥正极反应式:Cu+2e-==Cu2+ |
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为 。
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:

(2)在一定体积的18 mol?L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9mol,则该硫酸的实际体积 (填大于、等于或小于)100mL。
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗? (填“可行”或“不可行”)
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?
(填“同意”或“不同意”),原因是 。
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,请简述实验方案、实验现象及由此得出的结论: 。
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是
| 卡片号:2 2008.3.15,实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生 ③ ④若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤电子的流向是:Cu─→Zn ⑥正极反应式:Cu+2e-==Cu2+ |
A.①②③
B.②④
C.④⑤⑥
D.③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com