
题目列表(包括答案和解析)
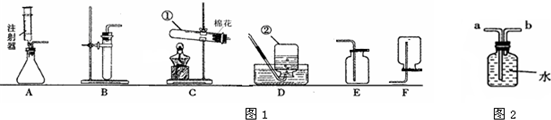
| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解; |

| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解; |

| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解; |

| 集气瓶标号 | 1 | 2 | 3 | 4 | 5 |
| 集气瓶中氧气的体积分数 | 28.9% | 36.8% | 44.7% | 52.6% | 60.5% |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
| 集气瓶标号 | 1 | 2 | 3 | 4 | 5 |
| 集气瓶中氧气的体积分数 | 28.9% | 36.8% | 44.7% | 52.6% | 60.5% |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com