
题目列表(包括答案和解析)
实验室中所用少量氯气用下列装置制取:
 |
试回答下列问题:
(1)写出该反应的离子方程式 。在该氧化还原反应中, HCl的作用是 。
(2)集气瓶B中盛装的是 。
(3)集气瓶C中盛装的是FeCl2溶液。实验开始后,C中反应的离子方程式为
。实验室中可用 检验反应生成的阳离子。在实验室也可用此反应的生成物来制备氢氧化铁胶体,请写出相应的化学方程式 。
(4)集气瓶D中盛装的是水,E装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,写出 E中反应的化学方程式 。
(5)在F处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
。
(6)若将F处的烧杯中的溶液改为澄清的石灰水,反应过程中的现象为 (选填标号)。
A.有白色沉淀 B.无现象 C.先生成白色沉淀而后消失
(7)氯气尾气直接排入大气中,会污染环境。实验室中可采用 来吸收有毒的氯气。该反应的离子方程式为 。
实验室中所用少量氯气用下列装置制取:
 |
试回答下列问题:
(1)写出该反应的离子方程式 。在该氧化还原反应中, HCl的作用是 。
(2)集气瓶B中盛装的是 。
(3)集气瓶C中盛装的是FeCl2溶液。实验开始后,C中反应的离子方程式为
。实验室中可用 检验反应生成的阳离子。在实验室也可用此反应的生成物来制备氢氧化铁胶体,请写出相应的化学方程式 。
(4)集气瓶D中盛装的是水,E装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,写出 E中反应的化学方程式 。
(5)在F处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
。
(6)若将F处的烧杯中的溶液改为澄清的石灰水,反应过程中的现象为 (选填标号)。
A.有白色沉淀 B.无现象 C.先生成白色沉淀而后消失
(7)氯气尾气直接排入大气中,会污染环境。实验室中可采用 来吸收有毒的氯气。该反应的离子方程式为 。

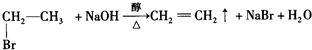
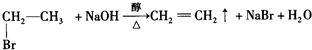







| ||
| ||
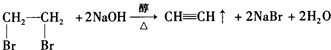
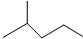 表示的分子式
表示的分子式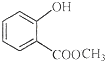 中含有的官能团的名称为
中含有的官能团的名称为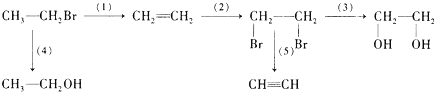
| 醇 |
| 加热 |
| 醇 |
| 加热 |
| 水 |
| 加热 |
| 水 |
| 加热 |
| ||
| 加热 |
| ||
| 加热 |
| 醇 |
| 加热 |
| 醇 |
| 加热 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com