
题目列表(包括答案和解析)
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为常见的致冷剂,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是 (写元素符号)(2分)M的化学式_______(1分)
(2)如何检验化合物N中的阳离子 (2分)
(3)写出K与H反应的离子方程式: (2分)
C与D反应的化学方程式: (2分)
(4)等物质的量F和H的混合气体通入品红溶液中的现象为 (2分),原因是(用离子反应方程式表示) (2分)
(5)实验中可用NaOH溶液来吸收多余的H,请写出此离子反应方程式
(2分)
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应①②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G极易溶于水且易液化.
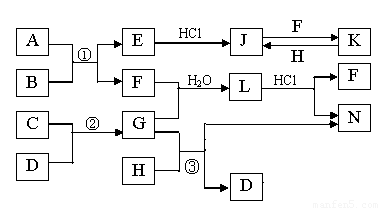
(1)化合物A中含有的短周期元素是 (写元素符号),E的化学式_______。
(2)如何检验化合物N中的阳离子 。
(3)写出③的化学方程式: 。
(4)若L为等物质的量F与G反应所得,L加入足量氢氧化钠溶液时反应的离子方程式为_______ ________
(5)已知C与D反应生成1.7g G 时放出4.62kJ的热量,则该反应的热化学方程式为
。
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应①②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G极易溶于水且易液化.
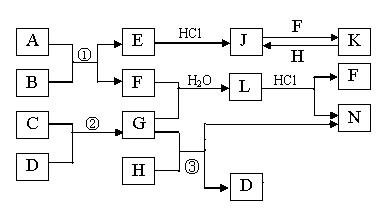
(1)化合物A中含有的短周期元素是 (写元素符号),E的化学式_______。
(2)如何检验化合物N中的阳离子 。
(3)写出③的化学方程式: 。
(4)若L为等物质的量F与G反应所得,L加入足量氢氧化钠溶液时反应的离子方程式为_______ ________
(5)已知C与D反应生成1.7g G 时放出4.62kJ的热量,则该反应的热化学方程式为
。
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应①②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G极易溶于水且易液化.
(1)化合物A中含有的短周期元素是 (写元素符号),E的化学式_______。
(2)如何检验化合物N中的阳离子 。
(3)写出③的化学方程式: 。
(4)若L为等物质的量F与G反应所得,L加入足量氢氧化钠溶液时反应的离子方程式为_______ ________
(5)已知C与D反应生成1.7g G 时放出4.62kJ的热量,则该反应的热化学方程式为
。
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为常见的致冷剂,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是 (写元素符号)(2分)M的化学式_______(1分)
(2)如何检验化合物N中的阳离子 (2分)
(3)写出K与H反应的离子方程式: (2分)
C与D反应的化学方程式: (2分)
(4)等物质的量F和H的混合气体通入品红溶液中的现象为 (2分),原因是(用离子反应方程式表示) (2分)
(5)实验中可用NaOH溶液来吸收多余的H,请写出此离子反应方程式
(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com