
题目列表(包括答案和解析)

 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
| 16 |
| 3 |
| 16 |
| 3 |
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
 ①温度升高,K值
①温度升高,K值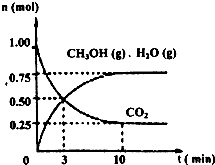 2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.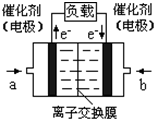 意图,则a处通入的是
意图,则a处通入的是2009年12月7日~18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议。而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:

① 从反应开始到平衡,氢气的平均反应速
 (H2)=_______。
(H2)=_______。
②下列措施中一定不能使 (CH3OH)/ (CO2)增大的是_____。
(CH3OH)/ (CO2)增大的是_____。
A.降低温度 B.缩小容器的容积
C.将水蒸气从体系中分离 D.使用更有效的催化剂
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的电离平衡常数K=___________。(已知:10-5.6=2.5×10-6)。
HCO3-+H+的电离平衡常数K=___________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为
________________;
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处的通入的是_____________(填“乙醇”或“氧气”),b处电极上发生的电极反应是___________
__________________________________________。

(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_______。
据新华社2009年5月9日电, 国务院总理温家宝主持召开国务院常务会议,会上通过了我国2009年将投入大量资金发展新能源汽车,支持节能、环保、安全等关键技术开发,为我国社会经济可持续发展打下良好基础,为今后改善环境、提升民众的生活质量具有极为重要的意义。请回答下列问题:
(1)氢能是理想的清洁能源,也是氢氧燃料电池的必不可少的物质。请回答下列问题。
①下列说法不正确的是 。
A.太阳光催化分解水制氢比电解水制氢更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池负极电极反应相同
D.氢氧燃料电池正极获得8mol电子,负极需要8g气体
②利用MnFe2O4为催化剂,通过两步反应使水分解制氢气,第一步反反应为:
MnFe2O4 MnFe2O4-X+(X/2)O2
MnFe2O4-X+(X/2)O2
则第二步反应的化学方程式为 (条件不写)。
③一种新能源汽车,使用了以碳纳米管为储氢介质的燃料电池,电池原理如右图,该电池的电解质为6mol/LKOH溶液,下列说法不正确的是 。

A.放电过程中整个体系内KOH浓度不变
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为:NiO(OH)+H2O+e—=Ni(OH)2+OH—
D.放电时,电池反应为2H2+O2→2H2O
(2)热值指在一定条件下每克物质完全燃烧所放出的热量(燃烧产物在该条件下是一种较为稳定的状态),下表是几种物质在常温常压下的热值数据。已知:管道煤气(47g/m3H2、625g/m3CO)价格为1.00元/m3,天然气(714g/m3CH4)的价格为2.50元/m3。
|
物质 |
H2 |
CO |
CH4 |
|
热值/kJ·g–1 |
143 |
10 |
56 |
①根据以上热值数据, 是最理想的燃料。
②家庭使用管道煤气和天然气, 更经济合算。
③表示CO燃烧热的热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com