
题目列表(包括答案和解析)
①在淀粉KI溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变蓝,这是因为 ,反应的离子方程式是 .
②在碘和淀粉形成的蓝色溶液中滴加亚硫酸钠溶液发现蓝色逐渐消失,这是因为 ,反应的离子方程式是 .
③对比①和②实验所得结果,将![]() 、
、![]() 、
、![]() 按氧化性由强到弱顺序排列为
.
按氧化性由强到弱顺序排列为
.
②在碘和淀粉形成的蓝色溶液中滴加亚硫酸钠溶液发现蓝色逐渐消失,这是因为 ,反应的离子方程式是 .
③对比①和②实验所得结果,将![]() 、
、![]() 、
、![]() 按氧化性由强到弱顺序排列为
.
按氧化性由强到弱顺序排列为
.
2- 4 |
| ||
| ||
(15分)某化学小组为测定加碘盐中KIO3的质是分数并制备少量KIO3,进行了如下实验。
I .测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知: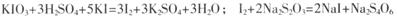
步骤一:准确称取a g加碘盐,配制成250 mL溶液;
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c mol.L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据。重复滴定2次,平均消耗Na2S2Or溶液12.00 mL。
(1) 步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有____________
(2) 步骤三中到达滴定终点时的现象为____________
(3) 实验测得此加碘盐中KIO3的质量分数="______" ______ (KIO3的相对分子质量为214)。
II.实验室制备KIO3
已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到。
该化学小组通过以下装置制备KIO3
(4) 装置A中反应的离子方程式为____________
(5) 装置B中的试剂为____________
(6) 写出装置C中生成KIO3的离子方程式____________。
(7) 上述实验装置存在一处明显缺陷,请指出: __________________。
(15分)某化学小组为测定加碘盐中KIO3的质是分数并制备少量KIO3,进行了如下实验。
I .测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知:
步骤一:准确称取a g加碘盐,配制成250 mL溶液;
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c mol.L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据。重复滴定2次,平均消耗Na2S2Or溶液12.00 mL。
(1) 步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有____________
(2) 步骤三中到达滴定终点时的现象为____________
(3) 实验测得此加碘盐中KIO3的质量分数=______ ______ (KIO3的相对分子质量为214)。
II.实验室制备KIO3
已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到。
该化学小组通过以下装置制备KIO3
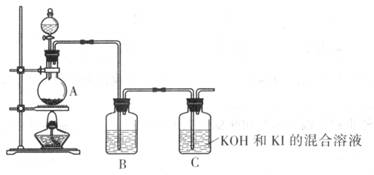
(4) 装置A中反应的离子方程式为____________
(5) 装置B中的试剂为____________
(6) 写出装置C中生成KIO3的离子方程式____________。
(7) 上述实验装置存在一处明显缺陷,请指出: __________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com