
题目列表(包括答案和解析)
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应: ;
银片上发生的电极反应: 。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023/mol,电子电荷为1.60×10-19 C)
|
已知0.1 mol/L邻苯二甲酸溶液的pH大于1,取等体积的邻苯二甲酸溶液和某KOH溶液混合,测得混合溶液的pH等于7,则碱与酸的浓度比值(x)为 | |
| [ ] | |
A. |
x>2 |
B. |
x=2 |
C. |
2>x>1 |
D. |
x=1 |
E. |
1>x> |
F. |
x= |
|
已知0.1 mol/L邻苯二甲酸溶液的pH大于1,取等体积的邻苯二甲酸溶液和某KOH溶液混合,测得混合溶液的pH等于7,则碱与酸的浓度比值(x)为 | |
| [ ] | |
A. |
x>2 |
B. |
x=2 |
C. |
2>x>1 |
D. |
x=1 |
E. |
1>x> |
F. |
x= |
(6分)氨在国民经济中占有重要的地位,请参与下列探究
(1)已知在400℃时,2NH3(g)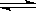 N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,
N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,
①400℃时,N2 (g)+ 3H2(g)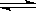 2NH3(g)的K= (填数值)。
2NH3(g)的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(NH3)正 V(NH3)逆(填:>、<、=、不能确定)。
(2)已知: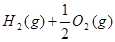 =H2O(l) △H=—285.8 kJ·
=H2O(l) △H=—285.8 kJ·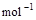 …①
…①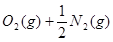 =NO2(g) △H=+33.9 kJ·
=NO2(g) △H=+33.9 kJ·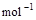 …②
…② 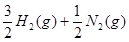 =NH3(g) △H=—46.0 kJ·
=NH3(g) △H=—46.0 kJ·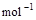 …③
…③
H2O(l)=H2O(g) △H=+44 kJ·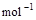 …④
…④
则表示NH3燃烧热的热化学方程式为
(8分)已知pH=2的高碘酸(H3IO5)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液呈酸性, 0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液均呈中性, 请回答下列问题:
(1)高碘酸是 (填写“强酸”或“弱酸”),原因是 。
(2)已知高碘酸和硫酸锰在溶液中反应生成高锰酸和碘酸及硫酸, 此反应的氧化剂是________,反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com