
题目列表(包括答案和解析)
为了充分利用原料、降低成本,现有3.5t质量分数为70%的硫酸和2.5t含杂质20%的烧碱,用铝屑最多能生产Al(OH)3,(设杂质不参加反应)
[ ]
|
为了充分利用原料、降低成本.现有3.5 t质量分数为70%的硫酸和2.5 t含杂质20%的烧碱,用铝屑最多能生产Al(OH)3(设杂质不参加反应)( ). | |
| [ ] | |
A. |
1.3 t |
B. |
2.5 t |
C. |
3.5 t |
D. |
5.2 t |
为了充分利用原料、降低成本.现有3.5t质量分数为70%的硫酸和2.5t含杂质20%的烧碱,用铝屑最多能生产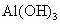 (设杂质不参加反应)
(设杂质不参加反应)
[ ]
 2009年12月在哥本哈根召开的联合国气候变化大会上,“控制温室气体排放”成
2009年12月在哥本哈根召开的联合国气候变化大会上,“控制温室气体排放”成
为会议讨论的焦点问题,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普
遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探
究反应原理,现进行如下实验,在体积为1 L的密闭容器中,
充入3molCO2和8mol H2,一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
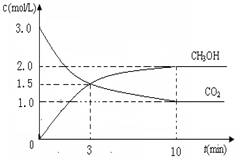
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)
②CO2的转化率为 。(保留一位小数)
③平衡常数K值为_____________;若升高温度K值将________。
④下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你
判断是否可行并说出理由:______________________________________________。
 2009年12月在哥本哈根召开的联合国气候变化大会上,“控制温室气体排放”成
2009年12月在哥本哈根召开的联合国气候变化大会上,“控制温室气体排放”成
为会议讨论的焦点问题,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普
遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探
究反应原理,现进行如下实验,在体积为1 L的密闭容器中,
充入3mol CO2和8mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
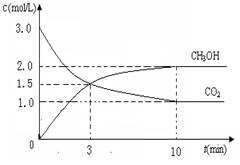
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)
②CO2的转化率为 。(保留一位小数)
③平衡常数K值为_____________;若升高温度K值将________。
④下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你
判断是否可行并说出理由:______________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com