
题目列表(包括答案和解析)
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
![]()
⑴若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为 。
⑵若D是具有氧化性的单质,A元素为第三周期的金属元素,则C的电子式为 。
⑶若D是生活中常见的过渡金属,A是黄绿色气体,则B→C的离子方程式为 。
⑷若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为 。
⑸若A为最简单的有机物,D是具有氧化性的单质。25℃、101 kPa时,3.2 g A完全燃烧生成稳定的氧化物时放出178kJ的热量。请写出表示物质A的燃烧热的热化学方程式 。
⑹若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有红色沉淀生成。则A生成B的化学方程为 。
(15分)
(1)已知:2SO2(g)+ O2 (g)  2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g)  2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g)  SO3 (g) +NO(g)的△H =______kJ·mol-1
SO3 (g) +NO(g)的△H =______kJ·mol-1
一定条件下,将NO2与SO2按体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d.每消耗1molSO3的同时生成1molNO2
(2)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g)  CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,
CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,
选择此压强的理由是 ________。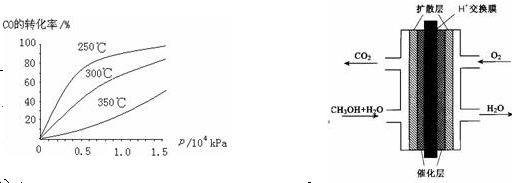
(3)甲醇(CH3OH)燃料电池的结构示意图如右上。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
(4)101 kPa时,若16 gCH3OH完全燃烧生成液态水,放出热量
为363.25 kJ/mol,则甲醇燃烧的热化学方程式为 。
 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1 SO3 (g) +NO(g)的△H =______kJ·mol-1
SO3 (g) +NO(g)的△H =______kJ·mol-1 CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,
CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,
右下图装置可用于多项定量实验。图中夹持固定装置已略去,甲有刻度,供量气用。
( 1 )装置中有刻度的甲管可以用______________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是______________________________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同。装置如右图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH 0.1 mol/L 40.00mL | HCl溶液 0.1 mol/L 40.00mL | 5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| …… | …… | …… |
请回答下列问题:
①每次实验至少需要用电子天平(能称准1 mg) 称取镁粉___________________g;
②冷却到25℃后,在读取气体体积时,首先应如何操作:__________________________;
③分析实验数据,t(a1)远远大于t(b1)的原因是__________________________。
(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮与6mol·L—1 NaOH溶液反应。回答下列问题:(已知锌的密度为 ρ g/cm3)
① 写出Zn镀层与NaOH溶液反应的离子方程式________________________________________
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入______(填仪器名称)
实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③ 已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol·L—1)。则镀锌铁皮的锌镀层厚度为_________________________cm。(写出数学表达式)
右下图装置可用于多项定量实验。图中夹持固定装置已略去,甲有刻度,供量气用。
( 1 )装置中有刻度的甲管可以用______________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是______________________________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同。装置如右图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH 0.1 mol/L 40.00mL | HCl溶液 0.1 mol/L 40.00mL | 5 | t(a1)="155" s | t(b1)="7" s |
| 10 | t(a2)="310" s | t(b2)="16" s | ||
| 15 | t(a3)="465"  s s | t(b3)="30" s | ||
| 20 | t(a4)="665" s | t(b4)="54" s | ||
| …… | …… | …… | ||
 ________。
________。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com