
题目列表(包括答案和解析)

| ||
| 实验步骤 | 实验操作 |
| I | 取一定质量的FeCO3固体置于坩埚中,高温燃烧至质量不再减轻,冷却至室温. |
| II | 取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解. |
| III | 向实验步骤II所得溶液中滴加KSCN溶液,溶液变红. |
| ||
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。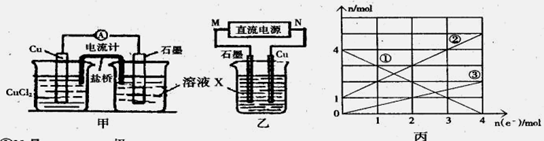
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是 ;
②Cu电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 离子(填“K+”或“Cl—”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入 L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O
 Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
③Na2FeO4能消毒、净水的原因 。
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:


①图中X溶液是_____________________________;
②石墨电极上发生的电极反应式为__________________________________________;
③原电池工作时,盐桥中的____________(填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是__________极;
②图丙中的②线是______________的变化。
③当电子转移为2 mol时,向乙烧杯中加入________ L 5 mol·L-1 NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O =Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
|
实验步骤 |
实验操作 |
|
Ⅰ |
取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
|
Ⅱ |
取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
|
Ⅲ |
向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
由此甲同学得出结论:4FeCO3+O2 2Fe2O3+4CO2
2Fe2O3+4CO2
(1)写出实验步骤Ⅲ中发生反应的离子方程式__________________________________。
(2)乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+。于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+。他需要选择的试剂是____________(填序号)。
a.氯水 b.氯水+KSCN溶液 c.K3[Fe(CN)6](铁氰化钾溶液)
(3)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分。你认为丙同学持此看法的理由是____________。
(4)丙同学进一步查阅资料得知,煅烧FeCO3的产物中的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、________ (填试剂名称)和氨水;再_________(填操作名称),灼烧,即可得到Fe2O3。
(5)工业上用氧化还原滴定法测菱铁矿中FeCO3的质量分数,通过控制样品的质量,使滴定时消耗KMnO4溶液体积为c mL,对应菱铁矿中FeCO3的质量分数为c%,可以简化计算。某同学取含FeCO3 c%的菱铁矿a g,用足量稀硫酸溶解后,再用0.0 200 mol·L-1的酸性KMnO4溶液滴定(KMnO4被还原成Mn2+),最终消耗KMnO4溶液c mL。假定矿石中无其他还原性物质,则所取菱铁矿的质量a=__________g。(FeCO3的摩尔质量为116 g·mol-1)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com