
题目列表(包括答案和解析)
| 可用下图所示的图象表示的反应是 | |||||||||||||||||||||||||
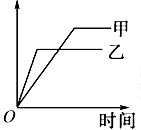 | |||||||||||||||||||||||||
|
[ ] | |||||||||||||||||||||||||
|

(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓硝酸反应产生的气体中含有NO?
甲__________;乙__________;丙________。(填“能”或“不能”)
具体说明不能验证的主要原因(若三个实验方案都能验证,则此小题不用回答)。
(2)反应前应先通入足量的N2,其目的是_______________________。
(3)确认气体中含有NO的现象是______________________。
(4)如果O2过量,则装置B中发生反应的化学方程式是_________________。
利用下图所示装置,选择适当试剂可完成实验A、B、C,并得出相应的实验结论。实验A、B、C所用试剂或所得结论列于下表中。
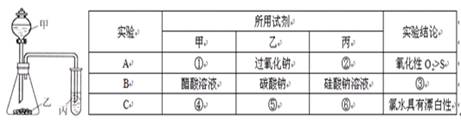
(1)请填写①-⑥的试剂名称或实验结论:
① ② ③
④ ⑤ ⑥
(2)请利用该装置自行设计一个有机实验D。回答下列问题:
实验所用试剂:甲 ,乙 ,丙 。
锥形烧瓶中反应的化学方程式为 ,大试管中的现象是 ;欲收集烧瓶中产生的气体,应采用 法,需补充的玻璃仪器至少有 。
(14分)下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒。反应②和④是化工生产中重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)物质E的电子式是__________;I中所含化学键类型为:____________________;气体D所含元素在周期表中的位置是____________________。
(2)G的水溶液呈__________性,用离子方程式表示其原因___________________________。
(3)写出E与过量I溶液反应原离子方程式______________________________。
(4)写出实验室制备气体C反应的化学方程式______________________________,干燥气体C可选用__________做干燥剂(填名称)。
(5)写出反应④的化学方程式__________________________________________________。
(6)反应③的现象为______________________________。
(7)已知含7.4g I的稀溶液与200mL 1 mol/L的H溶液反应放出11.56kJ的热量,
写出该反应的热化学方程式________________________________________。
(8)物质A由三种元素组成,1 molA与水反应可生成1 mol B和2 mol C,A化学式为______________________________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com