
题目列表(包括答案和解析)
“氢原子失去电子后,剩余1个质子构成的核,即氢离子。氢离子是'裸露'的质子,半径很小,易被水分子吸引生成水合氢离子,通常用H3O+表示。”下列是某同学对这段文字的理解:
①氢离子都是裸露的质子;
②11H失去电子变成裸露的质子;
③1mol H3O+含有6.02×1024个电子;
④电子数相等、原子总数相等的微粒互称为等电子体,等电子体的结构和性质相似,由此可推知H3O+呈正三角形;
⑤H3O+含极性共价键,不含非极性共价键。
其中不正确的是
| A | B | C | D | E | |
| 原子结构 | 失去电子后变成质子, | 最外层电子数是次外层电子数的3倍. | L层电子数等于K层和M层电子数之和. | 最外层电子排布为(n+1)sn(n+1)p(n+3). | |
| 物质性质 | 其最高价氧化物对应水化物的碱性是短周期元素中最强的. |
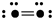 表示O2)
表示O2) B
B  C
C  D
D 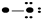
| ||
| ||
(1)某粒子一般不和其他元素的原子反应,这种粒子的符号是_______。
(2)某粒子氧化性甚弱,但得到电子后还原性很强,且这种粒子有一个单电子,这种粒子的符号是 。
(3)某粒子还原性虽弱,但失去电子后氧化性强,且这种原子得一个电子即达稳定结构,这种粒子的符号是 。
a,b,c,d,e是同周期的五种元素,比较a和b的最高价氧化物对应水化物的碱性是b>a;比较c和d的气态氢化物的还原性是d>c;五种元素的原子得到或失去电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是
A.baedc B.abdce C.ebadc D.cdeab
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com