
题目列表(包括答案和解析)
乙醇分子中不同的化学键如图所示,乙醇与金属钠反应,________键断裂:将乙醇与浓硫酸的混合液,温度升高到170℃时,________键断裂;在加热条件下,用铜作催化剂与氧气反应时,________断裂.

| |||||||||||||||

乙醇分子中不同的化学键如下图所示,乙醇与金属钠反应,________键断裂:将乙醇与浓硫酸的混合液,温度升高到170℃时,________键断裂;在加热条件下,用铜作催化剂与氧气反应时,________断裂.
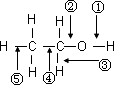

|

| 通电 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com