某研究性学习小组设计了一组实验验证元素性质的递变性规律.
(1)甲同学想验证同周期元素金属性强弱的规律,最好选用第
三
三
周期的
钠、镁、铝
钠、镁、铝
三种元素.最简单的实验是将大小相近的三小块金属分别投入相同浓度的稀盐酸中,观察现象.应该看到的现象是:
①
钠剧烈反应,可能着火或爆炸
钠剧烈反应,可能着火或爆炸
,
②
镁反应较剧烈,产生大量气泡
镁反应较剧烈,产生大量气泡
,
③
铝反应比镁缓慢,有较多的气泡产生
铝反应比镁缓慢,有较多的气泡产生
.
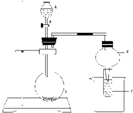
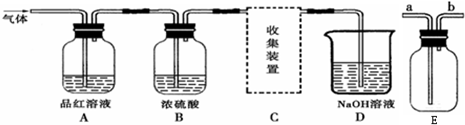
(2)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图所示装置以验证氮、碳、硅元素的非金属性强弱.
该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.
①写出所选用物质的化学式:
A:
HNO3
HNO3
;B:
CaCO3
CaCO3
;C:
Na2SiO3
Na2SiO3
.
②写出烧杯中发生反应的离子方程式:
CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-
CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-
.


 某研究性学习小组设计了一组实验验证元素性质的递变性规律.
某研究性学习小组设计了一组实验验证元素性质的递变性规律.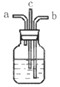 某研究性学习小组设计了一种给病人输氧时连在氧气钢瓶与呼吸面罩之间的湿化瓶(如图所示),下列连接方式中正确的是( )
某研究性学习小组设计了一种给病人输氧时连在氧气钢瓶与呼吸面罩之间的湿化瓶(如图所示),下列连接方式中正确的是( )