
题目列表(包括答案和解析)
在溶液中,反映![]() 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为![]() 、
、![]() 及
及![]() 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。
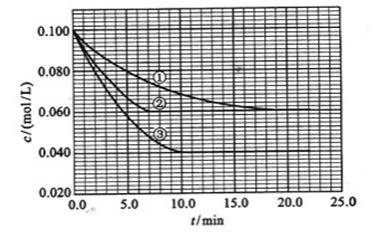
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_____________;
③______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为__________;
(3)该反应的![]() >0,判断其理由是________________;
>0,判断其理由是________________;
(4)该反应进行到4.0min时的平均反应速度率:
实验②:![]() =___________;
=___________;
实验③:![]() =_______________。
=_______________。
(15分)
在溶液中,反映![]() 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为![]() 、
、![]() 及
及![]() 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_____________;
③______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为__________;
(3)该反应的![]() >0,判断其理由是________________;
>0,判断其理由是________________;
(4)该反应进行到4.0min时的平均反应速度率:
实验②:![]() =___________;
=___________;
实验③:![]() =_______________。
=_______________。
(15分)
在溶液中,反映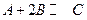 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为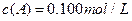 、
、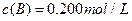 及
及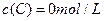 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。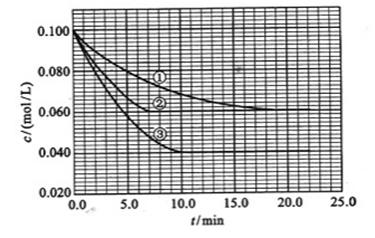

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_____________;
③______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为__________;
(3)该反应的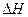 >0,判断其理由是________________;
>0,判断其理由是________________;
(4)该反应进行到4.0min时的平均反应速度率:[来源:学#科#网]
实验②: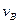 =___________;
=___________;
实验③: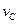 =_______________。
=_______________。
[来源:学科网ZXXK]
(15分)
在溶液中,反映 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为 、
、 及
及 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_____________;
③______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为__________;
(3)该反应的 >0,判断其理由是________________;
>0,判断其理由是________________;
(4)该反应进行到4.0min时的平均反应速度率:[来源:学#科#网]
实验②: =___________;
=___________;
实验③: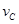 =_______________。
=_______________。
[来源:ZXXK]
在溶液中,反映![]() 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为![]() 、
、![]() 及
及![]() 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。
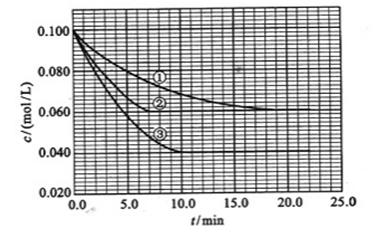
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_____________;
③______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为__________;
(3)该反应的![]() >0,判断其理由是________________;
>0,判断其理由是________________;
(4)该反应进行到4.0min时的平均反应速度率:
实验②:![]() =___________;
=___________;
实验③:![]() =_______________。
=_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com