
题目列表(包括答案和解析)
(18分)
Ⅰ. 氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。
请回答:
(1)实验室制取氨气的化学方程式是 。
(2)① 如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 。
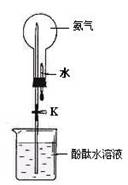
② 氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
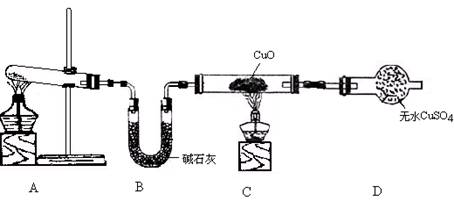
① 实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。
② 碱石灰的作用是 。
③ 整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求注明装置中所加试剂名称)。

Ⅱ. 3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO3-为 mol。
②所生成的NO在标准状况下体积为 L。(以上结果均用含a的代数式表示)
Ⅲ. 某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料知道:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图所示的实验:
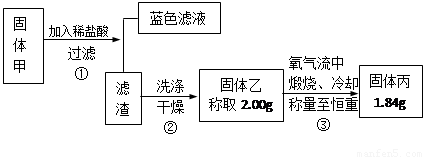
(1)③中在煅烧过程中一定发生的反应的化学方程式为 。
(2)关于固体甲的成分的判断中,下列说法正确的是
A.固体甲中,CuS和Cu2S不能同时存在;
B.固体甲中,CuO和Cu2O至少有一种;
C.固体甲中若没有Cu2O,则一定有Cu2S;
D.固体甲中若存在Cu2O,也可能有Cu2S。




| A.固体甲中,CuS和Cu2S不能同时存在; |
| B.固体甲中,CuO和Cu2O至少有一种; |
| C.固体甲中若没有Cu2O,则一定有Cu2S; |
| D.固体甲中若存在Cu2O,也可能有Cu2S。 |
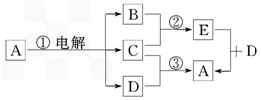
中学化学中常见的几种物质存在下图所示的转化关系。其中, A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)。

试回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式 。
(2)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为 。
(3)某课外小组同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。实验过程中观察到如下现象:

①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学认为使a变红的是
(写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因: 。
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成IO3-,从而使蓝色消失;二是 。
中学化学中常见的几种物质存在下图所示的转化关系。其中, A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)。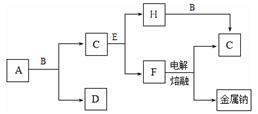
试回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式 。
(2)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为 。
(3)某课外小组同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。实验过程中观察到如下现象: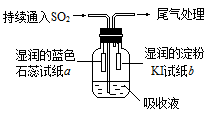
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学认为使a变红的是
(写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因: 。
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成IO3-,从而使蓝色消失;二是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com