
题目列表(包括答案和解析)
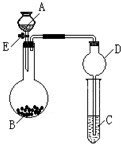 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题: 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题: 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:| 序号 | V(H2SO4)/mL | C(H2SO4)/mol?L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.| 序号 | V(H2SO4)/mL | c(H2SO4)/mol?L-1 | t/s | Ⅰ | 40 | 1 | t1 | Ⅱ | 40 | 4 | t2 |
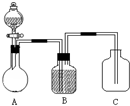 为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如图所示装置,一次实验即可达到目的(不必选用其他酸性物质).
为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如图所示装置,一次实验即可达到目的(不必选用其他酸性物质).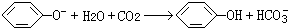
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com