
题目列表(包括答案和解析)
下列溶液中有关物质的量浓度关系正确的是
A.将0.2 mol/L的某一元弱酸HA溶液和0.1 mol/LNaOH溶液等体积混合,则充分反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA)
B.pH相等的CH3COONa溶液、C6H5ONa溶液、NaHCO3溶液和NaOH溶液,其物质的量浓度由小到大的顺序为:c (NaOH)<c(CH3COONa)<c (NaHCO3)<c (C6H5ONa)
C.常温下,将pH=2.0的CH3COOH溶液和pH=12.0的NaOH溶液等体积混合,则充分反应后的混合液中:c (Na+)>c (CH3COO-)>c(OH-)>c (H+)
D.常温下,向10mL pH=4.0的醋酸溶液中加入水稀释后,溶液中c(H+)、c(OH-)、c (CH3COOH)/c (CH3COO-)都将要变小
常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是 ( )
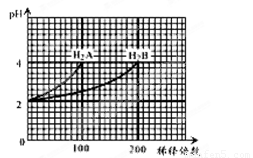
A.H2A的电离方程式为H2A===H++HA-,HA-  H++A2-
H++A2-
B.pH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合液离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
A.9.0 B.9.5 C.10.5 D.11.5
下列说法或化学方程式正确的是
A.用坩埚灼烧MgCl2·6H2O的反应式:MgCl2·6H2O MgCl2+6H2O
MgCl2+6H2O
B.在0.1mol•L-1 Na2SO3溶液中:c(Na+)=2c(SO32―)+ c(HSO3―)+ c(H2SO3)
C.常温下,将PH=2的稀硫酸稀释10倍,其中各离子的浓度都变为原来的十分之一
D.蛋白质肽链中-NH-上的氢原子与羰基上的氧原子形成氢键是蛋白质二级结构的主要依据
常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
| A.9.0 | B.9.5 | C.10.5 | D.11.5 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com