
题目列表(包括答案和解析)
(12分) 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题: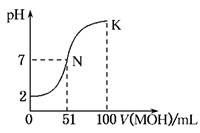
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是____________(2分)
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因为__________________________;,此时,溶液中由水电离出的c(OH-)=________。(4分)
(3)请写出K点所对应的溶液中离子浓度的大小关系:__________ (2分)
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH-)=________mol·L-1。(4分)
在给定条件下,下列加点的物质在化学反应中完全消耗的是
A.标准状况下,将1 g铝片投入20 mL 18.4 mol·L-1的硫酸中
B.常温下,向100 mL 3 mol·L-1的硝酸中加入6.4 g铜
C.在适当温度和催化剂作用下,用2 mol SO2和1 mol O2合成SO3
D.将含有少量H2O(g)的H2通入盛有足量Na2O2容器中并不断用电火花点燃
(12分) 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
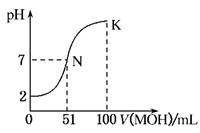
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是____________(2分)
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因为__________________________;,此时,溶液中由水电离出的c(OH-)=________。(4分)
(3)请写出K点所对应的溶液中离子浓度的大小关系:__________ (2分)
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH-)=________mol·L-1。(4分)
I:化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一。(1)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A.定性检验SO32-,可用HNO3酸化的BaCl2溶液
B.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
D.酸性高锰酸钾溶液经常用盐酸酸化
(2)下列有关说法中正确的有??????? ?
①用pH试纸测得氯水的pH为3.5
②用瓷坩埚高温熔融NaOH固体
③加入浓NaOH溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定含有NH4+
④向溶液中加入少量双氧水,再加几滴KSCN溶液后溶液变红,则原溶液中一定含有Fe2+
⑤实验时不慎被玻璃划破手指,引起轻微流血时,可用三氯化铁溶液涂抹止血
II:(1)某温度下,纯水中c(H+)=2.0×10-7mol·L-1.该温度下,0.9mol·L-1NaOH溶液与0.1mol·L-1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH= ???? 。
(2)向含有0.020 molCH3COOH的溶液中加入0.020mol CH3COONa固体,溶液pH增大,主要原因是 ?? ?? ;已知该混合溶液中c(Na+)<c(CH3COO-),则c(CH3COOH)?????? c(CH3COO-)(用“>”、“<”、“=”符号填空)。
(3)常温下,向100 mL 0.01mol·L-1HA溶液逐滴加入0.02mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。

回答下列问题:
①由图中信息可知HA为??? 酸(填“强”或“弱”)。
②K点对应的溶液中,c(M+)+c(MOH)=???? mol·L-1。
常温下,向100 mL pH=13的NaOH溶液中,滴加0.1mol/L的H2SO4溶液,当所得混合液的pH为12时,加入H2SO4溶液的体积约为( )
A.25mL B.36mL C.43mL D.82mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com