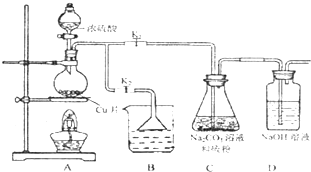
硫代硫酸钠(Na
2S
2O
3)可由亚硫酸钠和硫粉通过化合反应制得.
已知:Na
2S
2O
3在酸性溶液中不能稳定存在.
(1)某研究小组设计了制备Na
2S
20
3_5H
20装置和部分操作步骤如图.
I.打开K
1关闭K
2,向圆底烧瓶中加入足量浓硫酸,加热.
II.C中混合液被气流搅动,反应一段时间后,硫粉的域逐渐减少,当C中溶液的pH 接近7时,打开K
2,关闭K
1即停止C中的反应,停止加热.
III.过滤C中的混合液.
IV.将滤液经过
、
、过滤、洗潘、烘干,得到产品Na
2S
20
3.5H
20.
①II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是
(用离子方程式表示).
②IV中,操作步骤是
、
.
③装置B中盛放的试剂是(填化学式)
溶液.
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因
(2)常用Na
2S
2O
3溶液测定废水中Ba
2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K
2Cr
2O
7溶液,得BaCrO
4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO
全部转化为Cr
2O
;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010mol?L
-1 的Na
2S
2Cb溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 编号 |
1 |
2 |
3 |
4 |
| 消耗Na2S2O3标准溶液的体积/mL |
18.02 |
17.98 |
18.00 |
20.03 |
部分反应离子方程式为:
①Cr
2O
+6I
-+14H
+=2Cr
3-+3I
2+7H
2O;
②I
2+2S
2O
=2I
-+S
4O
.
则判断达到滴定终点的现象是
废水中Ba
2+的物质的量浓度
.

 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得. (2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.
(2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.